پنجشنبه 03 مهر 1399 کد خبر: 11
۱- مقدمه
با گسترش صنایع و زندگی مدرن، نیاز روزافزون بشر به تامین انرژی، امری غیر قابل انکار است. همچنین لازم است انرژی تولید شده به منظور استفاده مجدد و کاربرد آن در وسایل الکترونیکی قابل حمل، ذخیره شود. باتری وسیلهای الکتروشیمیایی [۱] است که در طی فرایند شارژ، انرژی الکتریکی را به عنوان انرژی شیمیایی در آند و کاتد خود ذخیره میکند و در صورت نیاز انرژی را به عنوان خروجی الکتریکی در هنگام تخلیه (دشارژ) آزاد میسازد. باتری ایدهآل میبایست ظرفیت بالایی داشته باشد، چگالی انرژی آن زیاد باشد، عمر بالا داشته باشد و قیمت آن بهصرفه باشد.
در این مقاله به معرفی نحوه کار باتریها بطور کلی و بررسی دو نوع از باتریهای متداول و همچنین کاربرد فناوری نانو در آنها خواهیم پرداخت. در مقالههای بعدی، به مطالعه باتریهای لیتیم - یون و باتریهای لیتیم هوا و با کاربردهای آنها میپردازیم.
۲- اصول الکتروشیمیایی در باتریها
۱-۲- واکنشهای اکسایش- کاهش
واکنشهایی هستند که در آنها عامل اصلی انجام واکنش، الکترونها میباشند؛ به این گونه از واکنشها، اکسایش-کاهش گفته میشود. در واکنشهای الکتروشیمی، اکسایش یعنی از دست دادن الکترون و کاهش یعنی به دست آوردن الکترون. یک ماده اکسیدکننده مادهای است که باعث اکسایش (اکسید شدن) ماده دیگری میشود و خود الکترون دریافت میکند؛ یک ماده کاهنده باعث کاهش ماده دیگری میشود و خود الکترون از دست میدهد. در زیر یک واکنش اکسایش-کاهش را مشاهده میکنید.
در این واکنش، آلومینیوم الکترونهای خود را از دست داده و یونهای مس آنها را دریافت میکنند و درنتیجه فلز مس روی آلومینیوم رسوب میکند. در این واکنش یونهای سولفات، نقش یونهای ناظر را دارند زیرا در هر دو طرف واکنش حضور داشته و تاثیری در فرایند واکنش ندارند.

شکل ۱. واکنش مس سولفات و آلومینیوم
۲-۲- پیلهای گالوانی [۲]
در پیلهای گالوانی از واکنشهای خودبهخودی اکسایش-کاهش برای تولید الکتریسیته استفاده میشود. واکنش مس سولفات و روی را در نظر بگیرید. این واکنش شامل دو نیمواکنش اکسایش و کاهش است.
کاهش
اکسایش
در این واکنش الکترونها جابجا میشوند ولی سیستم انرژی الکتریکی ایجاد نمیکند؛ زیرا عامل اکسنده (یون مس) و عامل کاهنده (فلز روی) هر دو در یک بشر قرار داده شدهاند. اگر این دو نیمواکنش به طور فیزیکی از هم جدا شده و با یک مدار خارجی
به هم وصل شوند، الکترونها با عبور از مدار خارجی جابجا شده و جریان الکتریکی ایجاد میگردد. در شکل ۲ پیل گالوانی مس-روی نشان داده شده است. نکات کلیدی در پیل گالوانی به صورت زیر است:
نیمپیل اکسایش: در این حالت، قسمت آند متشکل شده است از میله روی که داخل الکترولیت محلولی از روی فرورفته است. میله روی در نیمواکنش اکسایش واکنشگر است و به یون دو بار مثبت روی تبدیل میشود و الکترونهای آزاد شده را به خارج نیمپیل خود هدایت میکند.
نیمپیل کاهش: در این حالت، قسمت کاتد شامل میله مس میباشد که درون الکترولیت محلولی از مس فرو رفته است. فلز مس محصول نیمواکنش کاهش است و الکترود مسی الکترونها برای واکنش کاهش و تبدیل یون مس به فلز مس استفاده میکند.

شکل ۲. پیل گالوانی روی - مس
بار نسبی در الکترودها: بار نسبی الکترودها از منبع تولید الکترون و جهت جریان الکترونها در مدار تعیین میشود. در این پیل، اتمهای روی در آند اکسید شده و یونهای روی و الکترون ایجاد میکنند و یونها وارد محلول میشوند، در حالی که الکترونها از طریق میله روی به سیستم منتقل میشوند. الکترونها از سمت چپ به راست و از طریق سیم به کاتد میروند؛ جایی که یون مس در محلول آنها را دریافت کرده و به فلز مس کاهش مییابد. همانطور که پیل کار میکند، الکترون ها به طور مداوم در آند تولید و در کاتد مصرف میشوند. بنابراین آند الکترون اضافی داشته و بار آند نسبت به کاتد منفی و بار کاتد نسبت به آند مثبت است. در هر پیل گالوانی آند منفی و کاتد مثبت میباشد.
پل نمکی: وظیفه پل نمکی کامل کردن مدار و برقراری تعادل یونهای مثبت و منفی در نیمپیلها میباشد. برای مثال در نیمپیل اکسایش، یونهای مثبت روی به طور مداوم به الکترولیت وارد میشوند و غلظت یونهای مثبت افزایش مییابد. پل نمکی باعث ورود یونهای منفی به نیمپیل اکسایش میشود و الکترولیت خنثی باقی میماند در عین حالی که مدار الکتریکی را نیز کامل میکند.
الکترودهای فعال و نافعال: الکترودهای پیل روی-مس فعال میباشند، زیرا میلههای فلزی جرئی از نیمواکنش هستند. در بسیاری از واکنشهای کاهش، واکنشگر و یا محصول قابلیت در نظر گرفتن به عنوان الکترود وجود ندارد و الکترودهای نافعال به جای آنها مورد استفاده قرار میگیرد. در اغلب موارد الکترودهای نافعال میله گرافیت یا پلاتین میباشد. برای مثال در پیل گالوانی زیر، ذرات واکنشدهنده نمیتوانند به عنوان الکترود استفاده شوند و از الکترودهای گرافیتی در آنها استفاده میشود.
آند، اکسایش
کاتد، کاهش
در هر پیل گالوانی، بین دو نیمپیل اختلاف پتانسیلی وجود دارد که باعث حرکت الکترونها و جریان الکتریکی میشود. پتانسیل استاندارد هر نیمپیل از طریق اتصال آن به نیمپیل با الکترود استاندارد مرجع که پتانسیل آن صفر فرض شده است، اندازهگیری میشود. نیمپیل استاندارد شامل الکترود پلاتین در محلول یک مولار اسید قوی میباشد که گاز هیدروژن به صورت حباب در محلول آن وجود دارد. پتانسیل استاندارد پیل از طریق رابطه زیر به دست میآید:
برای مثال پتانسیل استاندارد الکترودهای مس و روی به ترتیب ۰/۳۴+ و ۰/۷۶- میباشد، بنابراین اختلاف پتانسیل پیل گالوانی روی- مس برابر با ۱/۱ ولت است.
۳- باتریها
باتریها با مهندسی هوشمندانه، نیمواکنشها و نیمپیلهای الکتروشیمیایی را در خود جای میدهند؛ ولی بر اساس همان اصول الکتروشیمیایی عمل میکنند. در حقیقت یک باتری از تعدادی پیل گالوانی که بطور سری مرتب شدهاند تشکیل میشود و از مجموع اختلاف پتانسیلهای تولید شده توسط نیمپیلها استفاده میکند. در این مقاله به بررسی باتری نوع اول پرداخته میشود. در مقالههای بعد، باتریهای نوع دوم و پیل سوختی مورد بررسی قرار میگیرند.
۱-۳- باتری نوع اول (غیر قابل شارژ) و نوع دوم (قابل شارژ)
باتری نوع اول را نمیتوان دوباره شارژ نمود بنابراین تا زمانی که مواد تشکیلدهنده به تعادل برسند، باتری کار میکند و با رسیدن به حال تعادل باتری میمیرد. برعکس باتریهای نوع اول، در باتریهای نوع دوم یا قابل شارژ، پس از تمام شدن انرژی الکتریکی آنها، واکنش پیل معکوس میشود و مواد اولیه مجددا تشکیل میگردند. به عبارت دیگر در این نوع باتریها، پیل گالوانی بطور متناوب به پیل الکترولیتی تبدیل میشود تا غلظت اجزای پیل را به حالت اولیه غیرتعادلی برگرداند. پیلهای الکترولیتی عملکردی مشابه پیلهای گالوانی اما برعکس آن را دارند؛ یعنی با اعمال انرژی الکتریکی، یک واکنش شیمیایی غیرخودبخودی را فعال میکنند.در ادامه باتریهای قلیایی و سرب-اسید را بررسی خواهیم کرد.
۴- باتری قلیایی
باتریهای قلیایی متداول دارای یک پوسته آندی روی هستند که مخلوطی از و خمیر و آب را در خود جای میدهند و کاتد میله گرافیت غیرفعال میباشد. نیم واکنشها عبارتند از:
آند (اکسایش)
کاتد (کاهش)
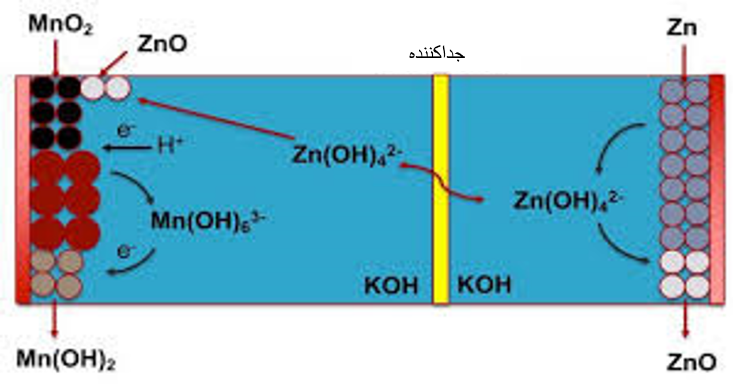
شکل۳. مکانیزم باتری قلیایی

شکل۴. اجزای باتری قلیایی
۱-۴- کاربرد فناوری نانو در باتری قلیایی
در صورتی که مساحت در دسترس الکترودها افزایش یابد، بارهای الکتریکی راحتتر جریان پیدا میکنند؛ همچنین ظرفیت باتری افزایش پیدا کرده و چرخه شارژ-دشارژ سریعتر انجام میشود.
نانوذرات به علت اندازه بسیار کوچک، سطح ویژه زیادی دارند و میتوانند باعث افزایش سطح در دسترس درالکترودها شوند. کاتد را میتوان از نانوساختارهای کربنی مانند نانولولههای کربنی یا گرافن ساخت که مساحت سطح بالایی دارند. همینطور در آند میتوان از نانوذرات روی استفاده کرد و بازده باتری را افزایش داد.
۵- باتری سرب-اسید
یک باتری معمولی سرب-اسید از شش پیل که بطور سری به هم وصل شدهاند، تشکیل شده است. هر یک از آنها ۲/۱ ولت و مجموعا ۱۲ ولت است. هر پیل متشکل از دو تیغه سربی است که از مواد الکترودی پر شده است. تیغه آند با سرب اسفنجی و تیغه کاتد با دیاکسید سرب پر شدهاند. تیغهها در محلول الکترولیت سولفوریک اسید فرورفتهاند.
آند( اکسایش)
کاتد(کاهش)
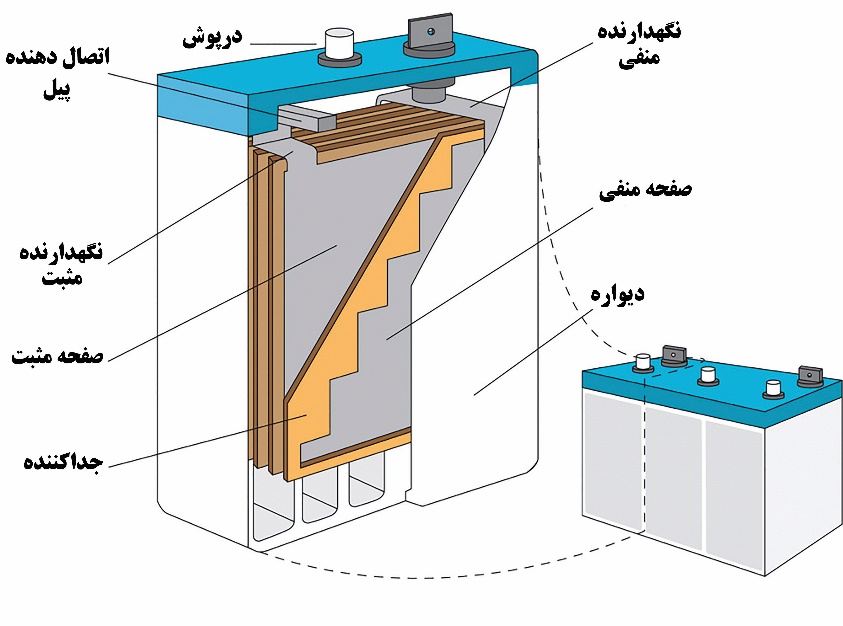
شکل۵. اجزای مختلف باتری سرب- اسید
صفحات پشم شیشه بین تیغهها از اتصال حاصل از تماس فیزیکی جلوگیری میکنند. وقتی پیل تخلیه میشود، مانند یک پیل گالوانی انرژی الکتریکی تولید میکند. واکنش کلی پیل هنگام تخلیه شدن باتری به صورت زیر است:
وقتی باتری شارژ میشود، از انرژی الکتریکی به عنوان یک پیل الکترولیتی استفاده میکند که باعث معکوس شدن پیل و واکنش کلی آن میشود.
۱-۵- کاربرد فناوری نانو در باتری سرب-اسید
یکی از محدودیتهای این باتریها به علت وزن بالای سرب، کم بودن c-rate آنها است. نرخ شارژ و دشارژ یک باتری با C-rate نشان داده میشود. ظرفیت یک باتری معمولا در ۱C ارزیابی میشود به این معنا که یک باتری کاملا شارژ با ۱Ah باید برای یک ساعت، یک آمپر برق تامین کند. همین باتری با نرخ ۰/۵C باید بتواند برای دو ساعت ۵۰۰ میلیآمپر برق و با ۲C، بتواند ۲ آمپر برق برای نیم ساعت تامین کند. بیشتر باتریها در جریانهایی با نرخ شارژ بالاتر، ظرفیت خود را از دست میدهند. در یک پژوهش به منظور افزایش این نرخ از نانومیلههای سرب و سربدیاکسید که به روش آبکاری [۳] الکتروشیمیایی تولید شدهاند، بهعنوان الکترود استفاده شدهاست. نتیجه استفاده از این نانوساختارها، افزایش C-rate تا ۱۰C و افزایش ظرفیت دشارژ تا ۱۰۰۰ چرخه است [۴]. در پژوهش دیگر از کربن بلک بهعنوان افزودنی آند استفاده شده و باعث افزایش تعداد چرخهها و همچنین افزایش ظرفیت باتری شده است [۵]. همچنین افزودن کربن فعال [۶] و نانولولههای کربنی [۷] باعث بهبود فعالیت باتریهای سرب-اسید میشود.
۶- جمعبندی و نتیجهگیری
باتریها ابزاری برای تامین انرژی الکتریکی میباشند. این انرژی از طریق واکنشهای الکتروشیمیایی به دست میآید. الکترونها در آند سلولهای الکتروشیمیایی تولید و در کاتد مصرف میشوند. انتقال الکترون در این دست واکنشها، مبنای تولید اختلاف پتانسیل در باتریها هستند. به طور کلی دو دسته باتری وجود دارد. باتریهای نوع اول که غیرقابل شارژ هستند و باتریهای نوع دوم که قابل شارژ میباشند. باتریهای قلیایی دستهای از باتریهای نوع اول هستند که آند آنها از جنس روی و کاتد آن از جنس گرافیت میباشد. با استفاده از نانوساختارهایی مانند گرافن میتوان ظرفیت این باتریها را افزایش داد. باتریهای سرب-اسید نوع دوم میباشند که آند از سرب و کاتد از دیاکسید سرب تشکیل شده است. در صورت استفاده از نانومیلههای سرب و سرب دیاکسید، میتوان ظرفیت باتری را افزایش داد.
۷- منابع
[1]Silberberg, Martin S. Chemistry: The Molecular Nature of Matter and Change. New York: McGraw-Hill,2012. Print.
[2]Layered vanadium and molybdenum oxides: batteries and electrochromics" - N. A. Chernova et al, J. Mat. Chem, 2009
[3]Carbon-coated silicon nanowire array films for high-performance lithium-ion battery anodes" - Huang et al, 2009
[4]A. Moncada, R. Inguanta, S. Piazza, and C. Sunseri, “Performance of Nanostructured Electrode in Lead Acid Battery,” vol. 43, no. 2013, pp. 751–756, 2015.
[5]A. Banerjee, B. Ziv, Y. Shilina, E. Levi, S. Luski, and D. Aurbach, “Single-Wall Carbon Nanotubes Doping in Lead-Acid Batteries : A New Horizon Single-Wall Carbon Nanotube Doping in Lead-Acid Batteries : A New Horizon,” 2017.
[6]B. Hong et al., “Characterization of nano-lead-doped active carbon and its application in lead-acid battery,” J. Power Sources, vol. 270, pp. 332–341, 2014.
[7]H. Hu et al., “applied sciences Enhancing the Performance of Motive Power Lead-Acid Batteries by High Surface Area Carbon Black Additives.”
۸- پاورقیها
[1] electrochemical
[2]Galvanic cell
[3]electroplating