پنجشنبه 03 مهر 1399 کد خبر: 12

۱- مقدمه
باتری لیتیم-یون متداولترین باتری مورد استفاده در تلفنهای همراه، لپتاپها و سایر وسایل الکترونیکی قابل حمل میباشد. سازوکار کلی آن همانند دیگر باتریهای قابل شارژ است و کاتد، آند و الکترولیت اجزای اصلی آن به شمار میروند. افزایش ظرفیت، ایمنی و عمر چرخه و کاهش هزینه، اهداف پژوهشها و شرکتها در راستای بهبود این باتریها میباشند. نانوساختارهایی مانند نانوپوششها و نانوذرات، نقش مهمی در این زمینه ایفا میکنند. در مقاله "باتریها و کاربردفناوری نانودر آنها" به ساختار باتریها و دو نوع باتری قلیایی و سرب-اسید پرداختیم. در این مقاله باتری لیتیم-یون و کاربردهایی که فناوری نانو در این باتری دارد، مورد بررسی قرارمیدهیم و در مقاله های بعدی به بررسی باتری لیتیم-هوا و تاثیرات فناوری نانو در آن خواهیم پرداخت.
در باتری نوع دوم لیتیم-یون، اتمهای لیتیم آند هستند و بین ورقههای گرافیت که با نشان داده میشوند، قرار گرفتهاند. کاتد اکسید فلز لیتیم مانند یا است و الکترولیت متداول در آن یک مولار در یک حلال آلی است. این حلال معمولا مخلوط دیمتیلکربنات و متیلاتیلکربنات میباشد. الکترونها در مدار جریان پیدا میکنند در حالیکه یون لیتیم از داخل پیل از آند به کاتد حرکت مینماید و هنگام شارژ شدن برعکس میشود.
آند(اکسایش)
کاتد(کاهش)
واکنش کلی پیل( ۳/۷ ولت)
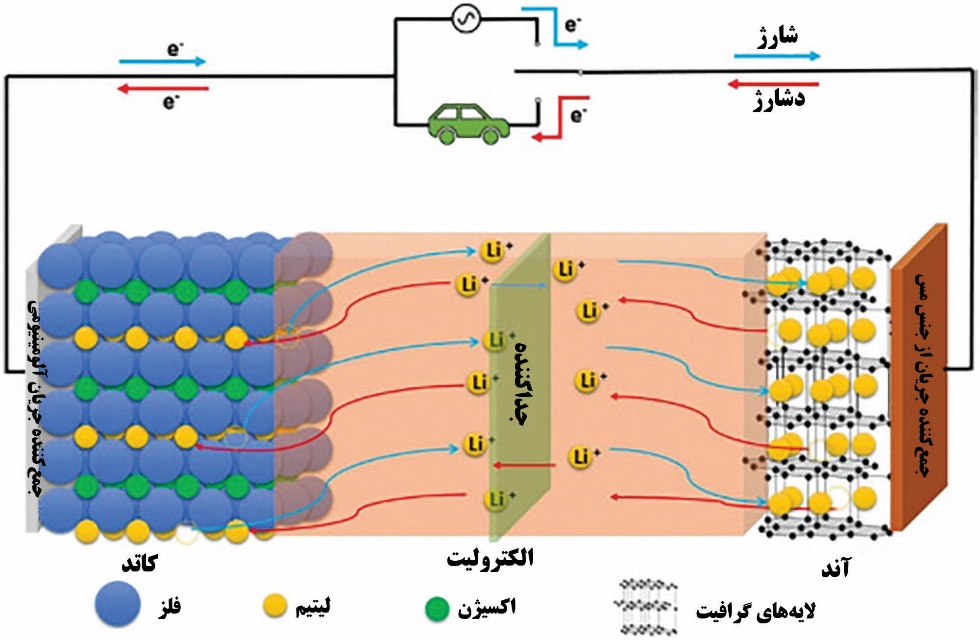
شکل ۱- مکانیزم و اجزای باتری لیتیم-یون
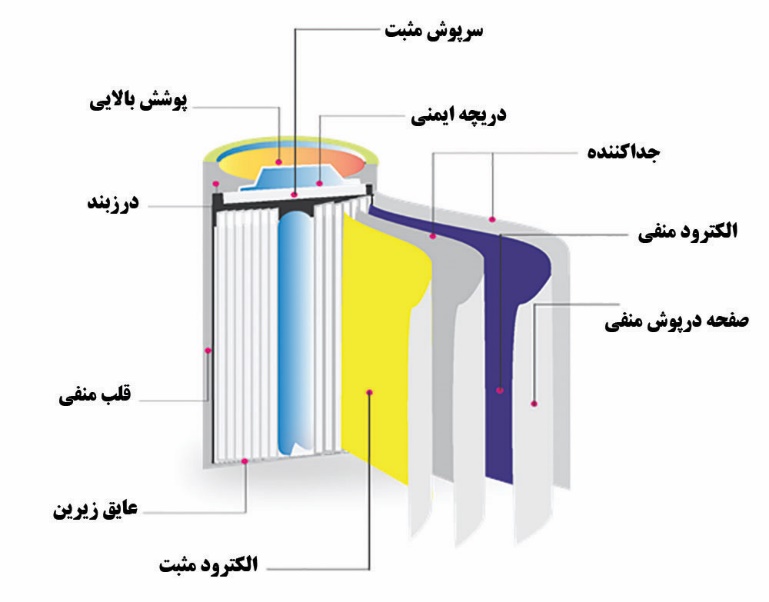
شکل۲- اجزای یک باتری استوانه ای لیتیم-یون
در ادامه اجزای باتری لیتیم-یون و کاربرد فناوری نانو در هر بخش را بررسی میکنیم.
بطور کلی، سه نوع کاتد در باتریهای لیتیم-یون استفاده میشوند. نوع اول، اکسیدهای لایهای[1] مانند که اولین کاتدهای مورد استفاده در این گونه باتریها به شمار میروند. اکسیدهای لایهای کانالهای دوبعدی برای نفوذ لیتیم دارند. نوع دوم، اسپینلها[2] مانند هستند که کانالهای نفوذ سهبعدی دارند. نوع سوم، اولیوینها[3] مانند هستند و کانالهای نفوذ یک بعدی دارند. شکل ۳ ساختار کریستالی هرکدام از انواع کاتدها را نشان میدهد [۲].

شکل ۳-ساختار کریستالی آ) اکسیدهای لایهای ؛ ب) اسپینلها؛ پ) اولیوینها
اولین اکسید لایهای است که به عنوان کاتد در باتری لیتیم-یون استفاده شده است. ظرفیت آن ۱۴۰ میلیآمپرساعت بر گرم و ولتاژ متوسط آن ۳/۹ ولت است. در عمل، تنها نیمی از لیتیم ذخیره شده در ماده خارج میشود. پژوهشهای زیادی به منظور افزایش میزان لیتیم خارج شده از کاتد و همچنین افزایش ولتاژ و عمر چرخهها انجام شده است. پوششدهی کاتدهایی که از اکسیدهای لایهای ساخته شدهاند با نانوپوششهایی از جنس اکسید فلزات مانند آلومینیوم، قلع، تیتانیوم، زیرکونیوم و منیزیم منجر به افزایش ولتاژ و عمر چرخهها میشود [۵-۳]. ایجاد نانوپوشش که باعث جلوگیری از تغییر ساختار کریستالی کاتد میشود [۶]، مانند یک مانع فیزیکی بین الکترولیت و ماده فعال عمل میکند و از رسیدن مقدار ناچیز هیدروژنفلوراید و آب درون الکترولیت به ماده فعال جلوگیری میکند [۷]. شکل ۴ نمایی از نانوپوشش بر روی کاتد را نشان میدهد.
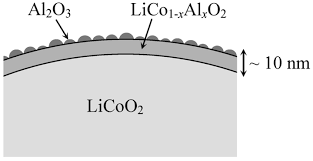
شکل ۴- نمایی از نانوپوشش اکسید آلومینیوم بر روی کاتد
نانوپوششهای اکسید فلزی همچنین میتوانند باعث افزایش پایداری حرارتی کاتد شوند [۸]. یکی از مشکلات هزینه بالای کبالت میباشد که تولید آن بهصورت انبوه را با چالش مواجه میکند. همچنین کبالت مادهای سمی به شمار میرود. به نسبت هزینه کمتری دارد و ساختار آن مشابه است. نیز در ولتاژهای بالاتر از ۴.۲ ولت دچار تغییر ساختار میشود و عمر چرخه در آن به شدت کاهش مییابد. بسیاری از نانوپوششهای اکسید فلزی مانند
دیاکسید زیرکونیوم باعث پایداری ساختاری میشوند و عمر چرخه را افزایش میدهند[۹]. پایداری حرارتی نیز با دوپکردن و پوششدهی با منیزیم بهبود پیدا میکند[۱۰]. دوپکردن به معنای وارد کردن یک ماده در یک ساختار بلوری به عنوان نقص بلوری است به طوریکه ساختار اولیه ماده دچار تغییر کلی نشود.
اسپینل کانالهای سهبعدی نفوذی دارند که باعث افزایش نرخ تحرکپذیری یونهای لیتیم میشود. همچنین، تولید آسان و ارزان میباشد و پایداری حرارتی قابل قبولی از خود نشان میدهد [۱۱]. یکی از مشکلات اسپینلها این است که اگر ولتاژ دشارژ از محدوده مشخصی خارج باشد، ساختار ماده تغییر میکند و منجر به کاهش ظرفیت باتری و کاهش طول عمر چرخه میشود. همچنین در ولتاژهای بالا مانند یک کاتالیست عمل میکند و الکترولیت غیرآبی را اکسید کرده و باعث تولید فراوردههای جانبی مضر میشود و دمای بالا این واکنش را تسریع مینماید [۱۲]. برای جلوگیری از این مشکلات لازم است تا یک لایه غیرفعالکننده [۴] مابین ماده و الکترولیت تشکیل شود. پوششها و دوپنت[۵](مواد دوپ شونده)های مختلفی به این منظور استفاده میشوند؛ مانند لیتیمبوراکسید، سیلیسیمدیاکسید، قلعدیاکسید، اکسیدمنیزیم، نقره، آلومینیوم و نانولولههای کربنی [۱۹-۱۳]. کامپوزیت / نانولوله کربنی، ظرفیت باتری را افزایش میدهد و همچنین در دستگاههای الکترونیکی انعطافپذیر کاربرد دارد. دوپکردن آلومینیوم منجر به افزایش میانگین ظرفیت منگنز میشود و در دماهای بالا از کاهش بازده باتری جلوگیری میکند.
اولیوینها مانند کاتدهای بهتری نسبت به دیگر ساختارها هستند؛ زیرا عمر چرخه آنها بیشتر بوده و ایمنی استفاده ازآنها بالاتر است. همچنین، آهن یکی از فراوانترین عناصر پوسته زمین است و بنابراین هزینه تولید این ماده کمتر از سایر کاتدها است. عمر چرخه بیشتر و ایمنی بالاتر این ساختار نسبت به دو ساختار دیگر، به دلیل کمتر بودن ولتاژ کاری آن است(۳/۴ ولت). در این اختلاف پتانسیل پایین، الکترولیتهای غیر آبی، پایدار هستند. با این وجود، کانالهای یکبعدی نفوذ برای یونها دارد و این منجر به کاهش رسانایی یونی آن میشود. همچنین رسانایی الکتریکی این ماده نیز ضعیف است؛ بهعلاوه چگالی آن نیز نسبت به دو ساختار دیگر کمتر است.
به منظور بهبود رسانایی الکتریکی میتوان سطح آن را با ساختارهای کربنی پوششدهی کرد [۲۰]. همچنین میتوان با کاهش اندازه ذرات رسانایی الکتریکی آن را افزایش داد. در پژوهشی نشان داده شده که استفاده از نانوصفحات با ضخامت ۳۰ تا ۴۰40 نانومتر با پوشش 5 نانومتری کربن آمورف که از طریق روش سولوترمال[۶] تهیه شدهاند، بهطور موثری عملکرد باتری را بهبود میدهد زیرا باعث کاهش مسافت مورد نیاز برای نفوذ لیتیم میشود [۲۱]. اگرچه کاهش سایز ذرات منجر به افزایش واکنشپذیری آنها میشود و میتواند تولید محصولات جانبی ناخواسته را به دنبال داشته باشد، استفاده از پوششهای کربنی نیز برای جلوگیری از این واکنشها میتواند کمک کننده باشد. استفاده از پوششهای کربنی دوپشده با سایر مواد نیز میتواند رسانایی الکتریکی را افزایش دهد. هنگامی که فسفر دوپشده در کربن بر روی کاتد لایه نشانی میشود، مقاومت در برابر انتقال بار کاهش مییابد که به دلیل وجود حاملهای فسفر میباشد [۲۲]. نانولولههای کربنی رساناهای الکتریکی بسیار مطلوب با سطح ویژه بسیار زیاد هستند. ساختار لولهای آنها اجازه میدهد تا در کاتد و آندهای فعال، نقش رسانایی یونی و الکتریکی را ایفا کنند. این کامپوزیت عملکرد بهتری در نرخ های بالا یا پایین C نسبت به دارد [۲۳].
ماده دیگری که میتوان به کاتد اضافه کرد، گرافن میباشد. گرافن لایهلایهای پیچیده شده دور میتواند ظرفیت ۲۰۸ میلیآمپرساعت بر گرم ایجاد کند. این ظرفیت بالا به علت واکنش کاهش برگشتپذیر بین لیتیم درون الکترولیت و صفحات گرافن است [۲۴]. روشی دیگر برای افزایش بازده باتری، تولید نانوسیمهای کپسوله شده در نانولولههای کربنی میباشد. این ساختار هسته پوسته از طریق روش سل-ژل[۷] تهیه میشود [۲۵].
گرافیت به عنوان اولین گزینه در آند باتریهای لیتیم-یون مورد استفاده بوده است. قیمت ارزان، پایداری مکانیکی و شیمیایی و ظرفیت بالا (۳۷۲ میلیآمپرساعت برگرم) باعث شده گرافیت ماده مورد استفاده در بسیاری از آندهای باتریهای لیتیم-یون تجاری باشد. با این وجود، گرافیت محدودیتهایی نیز دارد. برای مثال، الکترولیتهای آلی متداول (اتیلنکربنات، دیاتیلکربنات و پروپیلن کربنات) با آند گرافیتی واکنشهای برگشتناپذیر میدهند و منجر به تولید فراوردههای جانبی ناخواسته میشوند. یکی از روشهای جلوگیری از این فرایند، تشکیل الکترولیت جامد بین فازی [۸] به عنوان یک نانوپوشش محافظ، از طریق احیای مولکولهای اتیلنکربنات حین اولین چرخه است [۲۶]. این پوشش به حفاظت از گرافیت کمک میکند و از تغییرات شیمیایی الکترولیت جلوگیری میکند؛ اما نمیتواند بهطور کامل سطح آند را غیرفعال کند. به همین دلیل پژوهشهای دیگری برای حفاظت از آند گرافیتی از طریق اکسیداسیون سطحی و سایر نانوپوششها انجام شده است. در حال حاضر از سه نوع نانو پوشش استفاده میشود؛ کربن آمورف، فلز، اکسیدهای فلزی و پلیمر. پوششهای کربن آمورف معمولا از طریق رسوبدهی گرمایی بخار[۹] با استفاده از پیشمادههای آلی تولید میشود [۲۷]. پوششهای فلزی و اکسیدفلزی با ضخامت ۱۰ تا ۲۰ نانومتر، بهطور موثری واکنشهای جانبی را کاهش میدهند. پوششهای متداول این دسته عبارتند از Cu, Ni, Sn, Zn, Al, . [۲۸-۳۰] Ag, TiO2, MoO3.
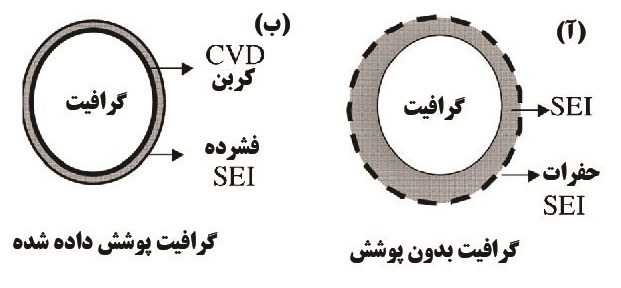
شکل۵- الف) آند بدون پوشش کربنی ب) آند با پوشش کربنی
اسپینل لیتیم تیتانات میتواند جایگزین کارآمدی برای گرافیت باشد؛ زیرا تغییر ساختاری ندارد و بهطور ذاتی یک آند ایمن است. اما به دلیل ساختاربلوری یکتا و گاف انرژی نسبتا بزرگ آن (۳-۲ الکترون ولت)، دو محدودیت ایجاد میکند؛ پایین بودن ظرفیت آن (۱۷۵ میلیآمپرساعت برگرم) نسبت به گرافیت و رسانایی یونی و الکتریکی کمتر نسبت به گرافیت. به منظور بهبود عملکرد لیتیمتیتانات میتوان از نانوذرات لیتیمتیتانات استفاده کرد، سطح آن را پوششدهی کرد و یا نانوساختارهای لیتیمتیتانات را در یک زمینه رسانا کامپوزیت نمود. استفاده از نانوساختارهای لیتیمتیتانات در آند به طور قابل توجهی مسیر نفوذ لیتیم درون ذرات را کاهش میدهد و همچنین سطح الکترود را افزایش میدهد که هردو عامل منجر به افزایش جریان دستگاه میشوند. در سالهای اخیر تلاشهای زیادی برای تولید انواع ساختارهای مختلف از طریق روشهای متنوع شده است. این روشها معمولا با دوپ کردن یونهای مختلف همراه بوده تا رسانش الکتریکی آند را افزایش دهند. پوششدهی سطح LTO انتقال بار بین آند و الکترولیت را تسهیل میکند و توان باتری را افزایش میدهد. بسیاری از پوششهایی که برای گرافیت استفاده میشود را برای LTO نیز میتوان استفاده کرد؛ مانند نقره، مس، کربن، قلع(IV) اکسید و ترکیبات رسانای آلی. کامپوزیت کردن LTO در زمینه رسانا منجر به افزایش رسانایی آند میشود. زمینه رسانا، نانوساختارهای LTO را در خود جای میدهد که مسیرهای کارآمد انتقال الکترون را ایجاد میکند (شکل ۶).
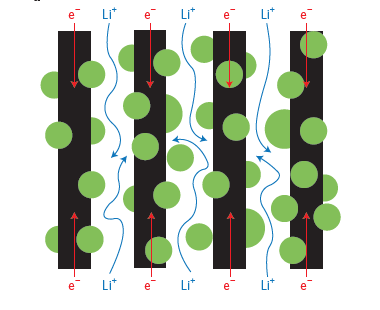
شکل۶- حرکت بارها درون کامپوزیت تیتانیوم دی اکسید/کربن
سیلیسیم توجه زیادی برای استفاده به عنوان آند را به خود جلب کرده است؛ زیرا ظرفیت آن برابربا ۳۵۷۲ میلیآمپرساعت برگرم است. عنصر سیلیسیم با لیتیم واکنش آلیاژی میدهد و ترکیبات دوتایی Li-Si را تشکیل میدهند. اما تغییرات فازی و حجمی مکرر منجر به کاهش ظرفیت و کاهش طول عمر چرخه میشود. به منظور بهبود خواص آند، از نانوساختارهای سیلیکونی مانند نانوسیمها [۳۱] یا نانولولههای سیلیسیم [۳۲] استفاده میشود. با ایجاد اتصال الکتریکی مناسب بین نانوساختارهای سیلیکونی و الکترولیت، ظرفیت باتری به ۲۰۰۰میلیآمپرساعت برگرم میرسد و عمر چرخهها افزایش مییابد. در پژوهشی دیگر، نانوذرات سیلیسیم بر روی کربن دندریتی قرار گرفتند [۳۳] که در این چنین ساختارها سیلیکون و کربن گرافیتی، هردو اجزای فعال هستند. کربن به عنوان زمینه رسانا برای انتقال موثر بار، جلوگیری از تغییرات حجمی سیلیسیم و میزبان یونِ لیتیم برای ظرفیت برگشتپذیر استفاده میشود. از طریق روش هیدروترمال[۱۰] و سولوترمال میتوان نانوسیمهای سیلیکونی را تهیه کرد و پس از پوششدهی آن با کربن، ظرفیت ۱۵۰۰ میلیآمپرساعت برگرم بدست میآید [۳۴]. روش دیگر استفاده از نانوذرات صنعتی سیلیکون و کپسوله کردن آنها در پوستههای کربنی است. با استفاده از این روش نه تنها مشکل تغییرات حجمی برطرف میشود، بلکه الکترولیت جامد بین فازی پایدار تولید میکند که باعث افزایش عمرچرخهها با ظرفیت ۱۲۰۰میلیآمپرساعت بر گرم میشود.
بهطور کلی استراتژیهایی که برای بهبود عملکرد آند مورد استفاده قرار میگیرند عبارتند از: طراحی نانوساختار با سطح زیاد و نفوذ بهتر لیتیم، ایجاد نانوپوشش برای جلوگیری از واکنشهای ناخواسته، ترکیب ساختارها با مواد رسانا برای بهبود رسانش الکتریکی آند.
الکترولیت در باتری وظیفه تسهیل انتقال یونها بین دو الکترود و تکمیل مدار و همچنین تامین جدایش فیزیکی به منظور جلوگیری از اتصال کوتاه در مدار را دارد. الکترولیت کارآمد باید ویژگیهای روبرو را داشته باشد: رسانایی یونی بالا در بازه دمایی ۳۰ تا ۱۰۰ درجه سلسیوس و قابلیت جابجایی آنیون و کاتیون، پایداری شیمیایی، گرمایی و الکتروشیمیایی، سازگاری با سایر عناصر باتری، هزینه کم و خطرات زیست محیطی پایین. اکثر باتریهای لیتیم-یون تجاری از الکترولیتهای مایع استفاده میکنند که از یک نمک لیتیم(مانند ) حل شده در مخلوطی از ترکیبات کربناتدار (مانند اتیلنکربنات و دیمتیلکربنات) تشکیل شده است [۳۵]. این الکترولیتها از رسانایی یونی بالایی برخوردارند و پایداری شیمیایی و حرارتی زیادی دارند. اما مشکل اصلی این الکترولیتها، استحکام مکانیکی ضعیف آنهاست که طراحی باتریها را محدود میکند و اشتعالپذیری آنها را بالا میبرد. به همین دلیل استفاده از الکترولیتهای جامد مانند الکترولیتهای پلیمری توجه زیادی را به خود جلب کرده است. الکترولیتهای جامد خواص مکانیکی بهتری دارند و ایمنتر هستند و میتوان از آنها برای انواع طراحی باتریها استفاده کرد. مهمترین محدودیت استفاده از این الکترولیتها، کم بودن رسانایی یونی آنهاست. بنابراین میتوان گفت که مشکل الکترولیتهای مایع، خواص مکانیکی نامطلوب و مشکل الکترولیتهای جامد، ضعف در رسانش یونی است. با استفاده از افزودنیهای نانوساختار میتوان این مشکلات را برطرف کرد. به منظور افزایش رسانایی الکترولیتهای جامد، نانوذرات سرامیکی مانند سیلیکات، آلومینیوماکسید و دیاکسید تیتانیوم به این پلیمرها اضافه میشوند و رسانش یونی این الکترولیتها را بهبود میدهند [۳۶]. همچنین مشاهده شده است افزودن این نانوذرات سرامیکی به الکترولیتهای مایع میتواند خواص مکانیکی آنها را بهبود بخشد. افزودن نانوذرات سیلیکات به الکترولیت مایع، الکترولیت بهبود یافتهای را تولید میکند که به آن "شنتر"[۱۱] گفته میشود.
جداکننده بخشی غیر فعال در باتری است که وظیفه آن جداکردن آند و کاتد از یکدیگر و جلوگیری از اتصال کوتاه است در حالیکه به یونهای لیتیم اجازه عبور میدهد. بنابراین جداکننده ایدهآل باید عایق باشد، استحکام مکانیکی بالایی داشته باشد، تحت شرایط کاری باتری به لحاظ شیمیایی بیاثر باشد و باید در الکترولیتهای مایع غیر آبی دارای خاصیت ترشوندگی باشد [۳۷]. متداولترین جداکنندههای باتریهای لیتیم-یون، جداکنندههای میکرومتخلخل میباشند. این جداکنندهها عمدتا از پلیاتیلن و پلیپروپیلن ساخته میشوند.
پایداری گرمایی، ترشوندگی و خواص مکانیکی جداکنندهها میتواند با استفاده از نانوپوششها بهبود یابد. پوششدهی جداکنندهها با نانوساختارهای معدنی مانند اکسیدآلومینیم یا سیلیکات، یا افزودن این نانوذرات به زمینه پلیمر، باعث افزایش پایداری حرارتی، خواص مکانیکی و ترشوندگی جداکننده میشود [۳۸].

شکل۷- تصویر میکروسکوپ الکترونی روبشی جداکننده ساخته شده از پلی اتیلن و پلی پروپیلن در دو بزرگنمایی متفاوت
باتوجه به فراگیر شدن استفاده از لوازم الکترونیکی قابل حمل، توسعه باتریهای این دستگاهها به امری ضروری تبدیل شده است. متداولترین باتری مورد استفاده در این وسایل، باتری لیتیم-یون میباشد.اتمهای لیتیم آند هستند و بین ورقههای گرافیت که با نشان داده میشوند، قرار گرفتهاند. کاتد اکسید فلز لیتیم مانند یا است و الکترولیت متداول در آن یک مولار در یک حلال آلی است. بهطور کلی سه نوع کاتد در این باتریها استفاده میشوند؛ اکسیدهای لایهای، اسپینلها و اولیوینها. گرافیت، لیتیمتیتانات و نانوکامپوزیتهای سیلیکون نیز بهعنوان آند این باتریها استفاده میشوند.به کمک فناوری نانو میتوان ظرفیت باتریها را افزایش داد، طول عمر چرخه را بهبود بخشید، پایداری اجزای درون باتری را بیشتر کرد و ایمنی باتری را افزایش داد.
۸- منابع
[1]Silberberg, Martin S. Chemistry: The Molecular Nature of Matter and Change. New York: McGraw-Hill,2012. Print.
[2] Brodd, R.J. Batteries for Sustainability: Selected Entries from the Encyclopedia of Sustainability Science andTechnology; Springer: New York, NY, USA, 2013.
[3]Cho, J.; Kim, C.S.; Yoo, S.I. Improvement of structural stability of LiCoO2 cathode during electrochemical cycling by sol–gel coating of SnO2. Electrochem. Solid State Lett. 2000, 3, 362–365.
[4] Chen, Z.; Dahn, J. Effect of a ZrO2 coating on the structure and electrochemistry of LixCoO2 when cycled to 4.5 V. Electrochem. Solid State Lett. 2002, 5, A213–A216.
[5] Wang, Z.; Wu, C.; Liu, L.; Wu, F.; Chen, L.; Huang, X. Electrochemical evaluation and structural characterization of commercial LiCoO2 surfaces modified with MgO for lithium-ion batteries. J. Electrochem. Soc. 2002, 149, A466–A471.
[6] Cho, J.; Kim, Y.J.; Park, B. Novel LiCoO2 cathode material with Al2O3 coating for a Li ion cell. Chem. Mater.2000, 12, 3788–3791.
[7] Dahéron, L.; Dedryvere, R.; Martinez, H.; Flahaut, D.; Ménétrier, M.; Delmas, C.; Gonbeau, D. Possible explanation for the efficiency of Al-based coatings on LiCoO2: Surface properties of LiCo1-xAlxO2 solid solution. Chem. Mater. 2009, 21, 5607–5616.
[8] Kweon, H.J.; Park, J.; Seo, J.; Kim, G.; Jung, B.; Lim, H.S. Effects of metal oxide coatings on the thermal stability and electrical performance of LiCoO2 in a Li-ion cell. J. Power Sources 2004, 126, 156–162. 56. Tan, K.; Reddy, M.; Rao, G.S.; Chowdari, B. High-performance LiCoO2 by molten salt (LiNO3:LiCl) synthesis for Li-ion batteries. J. Power Sources 2005, 147, 241–248.
[9] Cho, J.; Kim, T.-J.; Kim, Y.J.; Park, B. High-performance ZrO2-coated LiNiO2 cathode material. Electrochem. Solid State Lett. 2001, 4, A159–A161.
[10] Brodd, R.J. Batteries for Sustainability: Selected Entries from the Encyclopedia of Sustainability Science and Technology; Springer: New York, NY, USA, 2013.
[11] Doughty, D.; Roth, E.P. A general discussion of Li ion battery safety. Electrochem. Soc. Interface 2012, 21, 37–44.
[12] Tsunekawa, H.; Tanimoto, S.; Marubayashi, R.; Fujita, M.; Kifune, K.; Sano, M. Capacity fading of graphite electrodes due to the deposition of manganese ions on them in Li-ion batteries. J. Electrochem. Soc. 2002, 149,A1326–A1331.
[13] Arumugam, D.; Kalaignan, G.P. Synthesis and electrochemical characterizations of Nano-SiO2-coated LiMn2O4 cathode materials for rechargeable lithium batteries. J. Electroanal. Chem. 2008, 624, 197–204.
[14] Wang, L.; Zhao, J.; Guo, S.; He, X.; Jiang, C.; Wan, C. Investigation of SnO2-modified LiMn2O4 composite as cathode material for lithium-ion batteries. Int. J. Electrochem. Sci. 2010, 5, 1113–1126.
[15] Gnanaraj, J.; Pol, V.; Gedanken, A.; Aurbach, D. Improving the high-temperature performance of LiMn2O4 spinel electrodes by coating the active mass with MgO via a sonochemical method. Electrochem. Commun. 2003, 5, 940–945.
[16] Zhou,W.J.; He, B.L.; Li, H.L. Synthesis, structure and electrochemistry of Ag-modified LiMn2O4 cathode materials for lithium-ion batteries. Mater. Res. Bull. 2008, 43, 2285–2294.
[17] Huang, S.; Wen, Z.; Yang, X.; Zhu, X.; Lin, B. Synthesis and the Improved High-Rate Performance of LiMn2O4/Ag Composite Cathode for Lithium-Ion Batteries. Electrochem. Solid State Lett. 2006, 9, A443–A447.
[18] Ding, Y.; Xie, J.; Cao, G.; Zhu, T.; Yu, H.; Zhao, X. Enhanced elevated-temperature performance of Al-doped single-crystalline LiMn2O4 nanotubes as cathodes for lithium ion batteries. J. Phys. Chem. C 2011, 115, 9821–9825.
[19] Jia, X.; Yan, C.; Chen, Z.;Wang, R.; Zhang, Q.; Guo, L.;Wei, F.; Lu, Y. Direct growth of flexible LiMn2O4/CNT lithium-ion cathodes. Chem. Commun. 2011, 47, 9669–9671.
[20] Ravet, N.; Goodenough, J.; Besner, S.; Simoneau, M.; Hovington, P.; Armand, M. Improved iron based cathode material. In Proceedings of the 196th ECS meeting, Honolulu, HI, USA, 17–22 October 1999.
[21] Saravanan, K.; Reddy, M.; Balaya, P.; Gong, H.; Chowdari, B.; Vittal, J.J. Storage performance of LiFePO4 nanoplates. J. Mater. Chem. 2009, 19, 605–610.
[22] Jinli, Z.; Jiao, W.; Yuanyuan, L.; Ning, N.; Junjie, G.; Feng, Y.; Wei, L. High-performance lithium iron phosphate with phosphorus-doped carbon layers for lithium ion batteries. J. Mater. Chem. A 2015, 3, 2043–2049.
[23] Zhou, Y.; Wang, J.; Hu, Y.; O’Hayre, R.; Shao, Z. A porous LiFePO4 and carbon nanotube composite. Chem. Commun. 2010, 46, 7151–7153.
[24] Hu, L.H.; Wu, F.Y.; Lin, C.T.; Khlobystov, A.N.; Li, L.J. Graphene-modified LiFePO4 cathode for lithium ion battery beyond theoretical capacity. Nat. Commun. 2013, 4, 1687.
[25] Yang, J.;Wang, J.; Tang, Y.;Wang, D.; Xiao, B.; Li, X.; Li, R.; Liang, G.; Sham, T.K.; Sun, X. In situ self-catalyzed formation of core–shell LiFePO4@CNT nanowires for high rate performance lithium-ion batteries. J. Mater. Chem. A 2013, 1, 7306–7311.
[26] Jeong, S.-K., Inaba, M., Abe, T. & Ogumi, Z. Surface film formation on graphite negative electrode in lithium-ion batteries: AFM study in an ethylene carbonate-based solution. J. Electrochem. Soc. 148, A989–A993 (2001).
[27] Yoshio, M. et al. Improvement of natural graphite as a lithium-ion battery anode material, from raw flake to carbon-coated sphere. J. Mater. Chem. 14, 1754–1758 (2004).
[28] Gao, J. et al. Suppression of PC decomposition at the surface of graphitic carbon by Cu coating. Electrochem. Commun. 8, 1726–1730 (2006).
[29] Yang, L. C., Guo, W. L., Shi, Y. & Wu, Y. P. Graphite@MoO3 composite as anode material for lithium ion battery in propylene carbonate-based electrolyte. J. Alloys Compd. 501, 218–220 (2010).
[30] Lu, W., Donepudi, V. S., Prakash, J., Liu, J. & Amine, K. Electrochemical and thermal behavior of copper coated type MAG-20 natural graphite. Electrochim. Acta 47, 1601–1606 (2002).
[31] Hertzberg, B., Alexeev, A. & Yushin, G. Deformations in Si–Li anodes upon electrochemical alloying in nano-confined space. J. Am. Chem. Soc. 132, 8548–8549 (2010).
[32] Choi, N.-S., Yao, Y., Cui, Y. & Cho, J. One dimensional Si/Sn-based nanowires and nanotubes for lithium-ion energy storage materials. J. Mater. Chem. 21, 9825–9840 (2011).
[33] Ma, H. et al. Nest-like silicon nanospheres for high-capacity lithium storage. Adv. Mater. 19, 4067–4070 (2007).
[34] Chan, C. K., Patel, R. N., O’Connell, M. J., Korgel, B. A. & Cui, Y. Solution-grown silicon nanowires for lithium-ion battery anodes. ACS Nano 4, 1443–1450 (2010).
[35] Sazhin SV, Harrup MK, Gering KL (2011) Characterization of low-flammability electrolytes for lithium-ion batteries. J Power Sources 196(7): 3433–3438.
[36] Walls HJ, Riley MW, Singhal RR, Spontak RJ, Fedkiw PS, Khan SA (2003) Nanocomposite electrolytes with fumed silica and hectorites clay networks: passive versus active fillers. Adv Funct Mater 13(9):710–717.
[37] Zhang, H.; Zhou, M.Y.; Lin, C.E.; Zhu, B.K. Progress in polymeric separators for lithium ion batteries. RSC Adv. 2015, 5, 89848–89860.
[38] Liu, H.; Xu, J.; Guo, B.; He, X. Effect of Al2O3/SiO2 composite ceramic layers on performance of polypropylene separator for lithium-ion batteries. Ceram. Int. 2014, 40, 14105–14110.
۹- پاورقیها
[1] Layered oxides
[2] Spinels
[3] Olivines
[4] Passivation layer
[5] Dopant
[6] Solvothermal
[7] Sol-gel
[8] Solid-electrolyte interphase(SEI)
[9] Thermal vapour deposition (TVD)
[10] Hydrothermal
[11] Soggy sand
[12] Separator