شنبه 27 دی 1399 کد خبر: 83

۱- مقدمه
تجمع حداکثری مواد دارویی در محل سلول، یا اجزای داخل سلولی بافتهای آسیبدیده، یکی از مهمترین چالشهای تحویل داروهای درمانی از دیرباز تاکنون بوده است. احتمال شکست پیوندهای شیمیایی اجزای مولکولی دارو، مواجهه با باقیماندۀ مولکولهای دارویی از نوبت مصرف قبلی[۱]، مقابله با اتصالات سخت بین سلولی در قسمتهای مختلف بدن، موانع زیستی مختلفی از محل گردش در خون، جهت رسیدن دارو به بافت هدف ایجاد میکند. موانع سلولی مختلف مثل سدخونی-مغزی، سیستمهای بسیار پیچیدهای هستند که از چندین عنصر (یک لایه سلولهای اندوتلیوم مویرگی، یک لایه سلولهای پوششی بافت مورد هدف و غشای سلولها) و چند جزء (موانع مکانیکی یا فیزیکوشیمیایی و موانع آنزیمی) تشکیل شده است. در حال حاضر تحویل خاص داروهای درمانی به یک اندام، بافت، سلول یا یک نوع اندامک داخل سلولی خاص، یک مسئلۀ اساسی برای برای درمان بیماریهای مختلف انسانی، به ویژه بیماریهای عفونی، ژنتیکی و سرطان است[۲].
نانوسامانههای تحویل دارو با روش هدفگیری غیرفعال در درمان سرطان، بر پایۀ بهرهبرداری از خصوصیات مخفیشدن ذرات در برابر سیستم ایمنی، اثر [۳] و ریزمحیط خاص تومورمثل معماری نامنظم و نشتی بودن رگهای تازه شکل گرفته صورت میگیرد. با این حال تنها درصد کمی از (معمولاً<۱٪) نانوحاملهای دارو به محل تومور میرسند. از این رو، برای هدفگیری نانوذرات حامل دارو به سمت سلولها و حتی اندامکهای ویژه در بافت مورد هدف آنها ابزار قدرتمندی مورد نیاز است[۱]. پیشرفتهترین رویکرد دارورسانی، روش هدفگیری فعال است[۵]، که در آن اصلاح سطحی نانوحاملها با مولکولهای مختلف، میزان جذب سلولی مواد دارویی در سلولهای مورد هدف را، به صورت انتخابی افزایش داده و از تخریب آنزیمی نانوذرات نیز جلوگیری میشود[۶]. بنابراین با استفاده از لیگاندهای فعال، ویژگیهای هدفگیری را میتوان بهبود بخشید و با امکان گردش در خون با مدت زمان طولانی، سمیت سیستمیک نسبت به سلولهای سالم کاهش یابد[۳]. درشکل (۱) به طور شماتیک مقایسه هدفگیری فعال و غیرفعال نشان داده شده است. در این مقاله به طور ویژه درمورد انواع مولکولهای مورد استفاده در روش هدفگیری فعال بررسی میشوند.
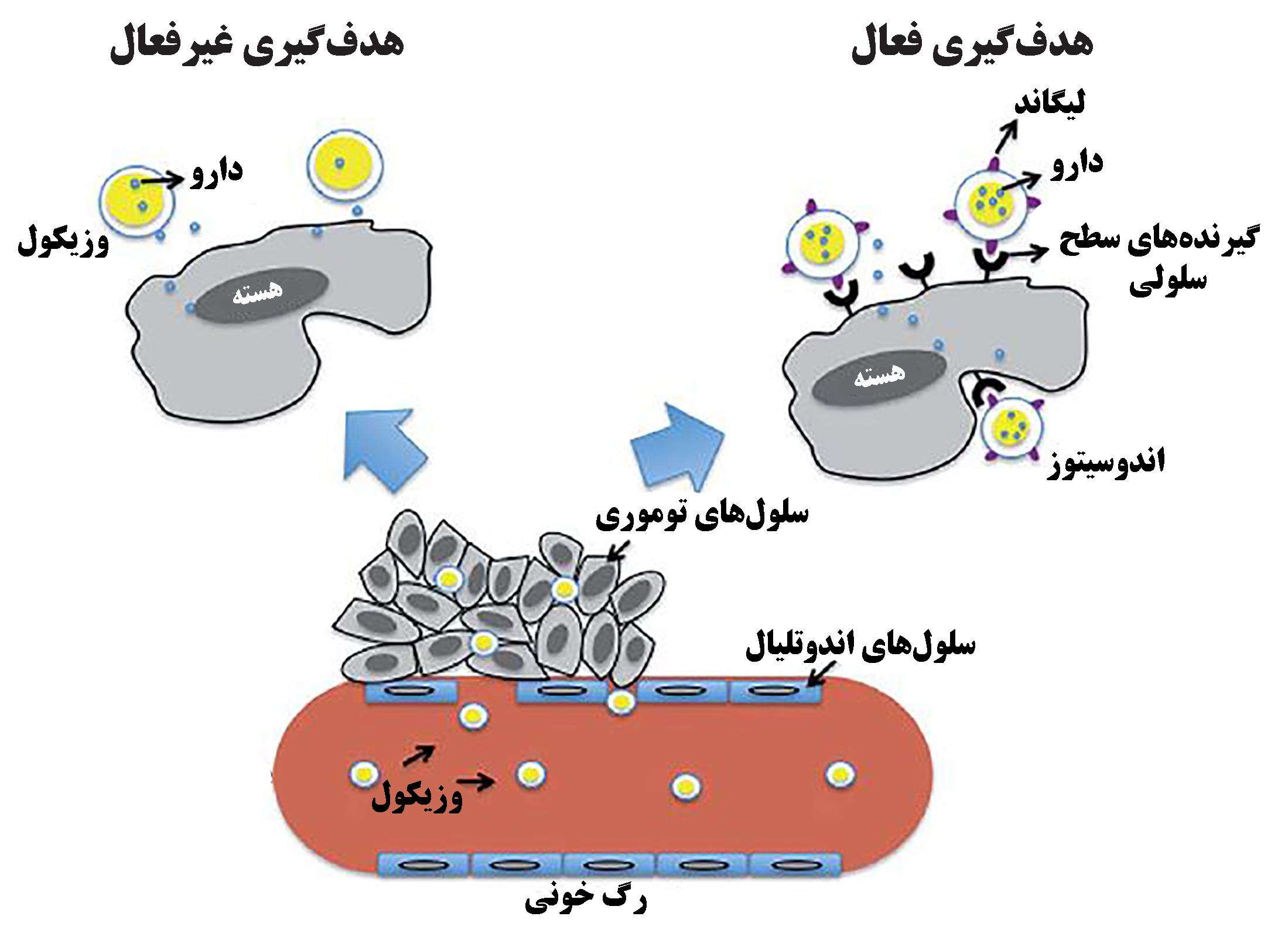
شکل ۱- مقایسه هدفگیری فعال و غیرفعال[۴]
۲- هدفگیری فعال
انواع مختلف مولکولهای سطحی (لیگاند) که در رویکرد هدفگذاری فعال به کار میروند شامل آنتیبادیها، قطعات مونوکلونال، پپتیدها، اسیدهای نوکلئیک (آپتامرها) و یا مولکولهای کوچک (مانند قندها و اسیدفولیک) هستند که سامانههای حامل دارو را به طور انتخابی به سمت گیرندههای مربوط به خود بر روی سلولهای سرطانی یا اندوتلیال عروق هدایت میکنند[۵](شکل۲).
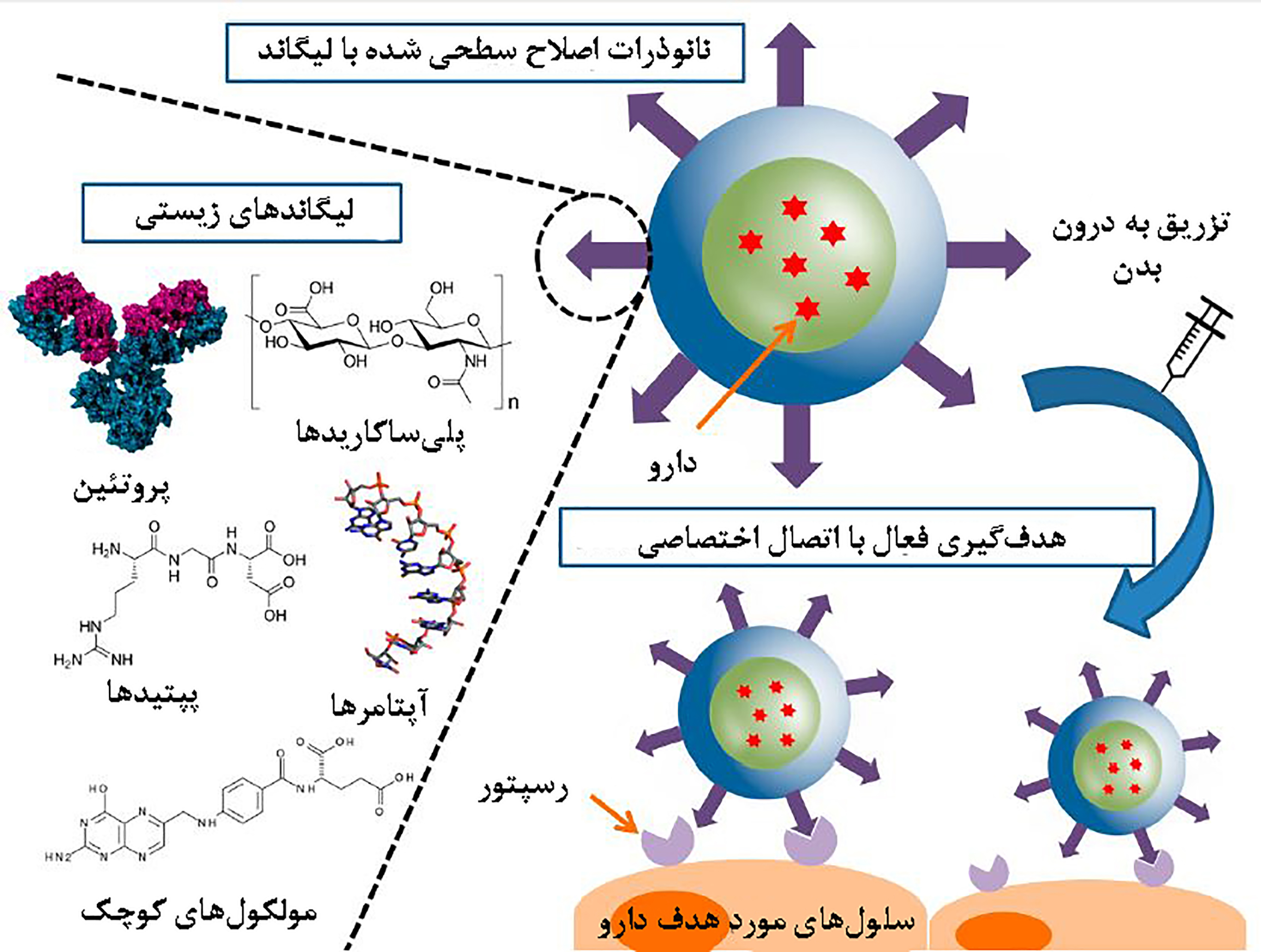
شکل ۲- لیگاندهای زیستی برای هدفگیری فعال نانوذرات حامل دارو [۷]
پس از رسیدن به محل هدف فرآیندهای مختلفی از قبیل آزاد شدن دارو در محیط خارج سلولی(شماره۱ در شکل۳)، اتصال نانوسامانه به رسپتورهای اختصاصی و رهاسازی دارو (شماره۲ در شکل۳) و یا درونی شدن نانوحامل و رهایش دارو در داخل سلول (شماره۳ در شکل۳) اتفاق میافتد[۸].
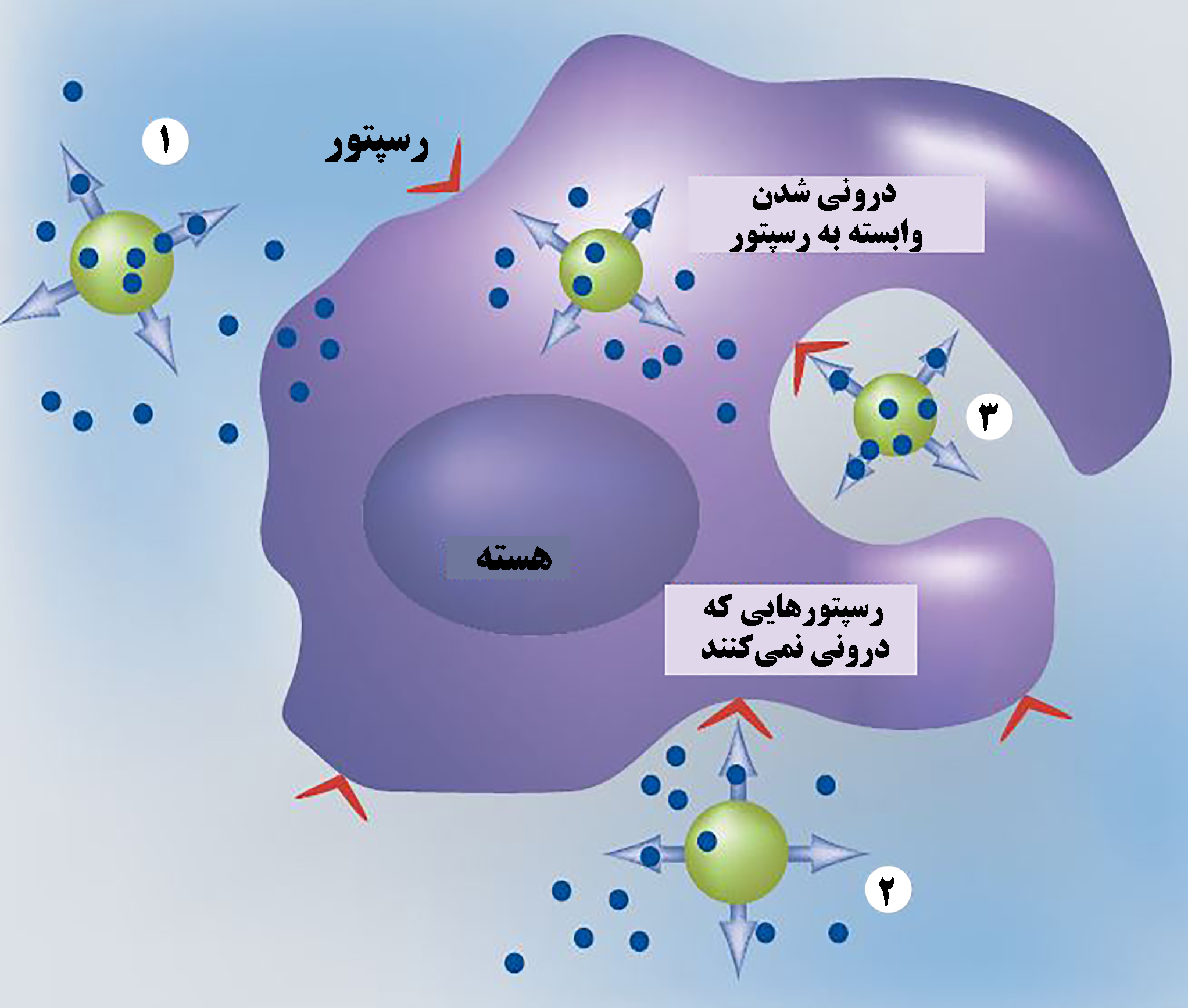
شکل ۳- سازوکارهای رهایش دارو در هنگام رسیدن به تومور[۸]
۳- هدفگیری سلول سرطانی
نانوسامانههای هدفمند با لیگاند، سلولهای سرطانی را در خارج از ریزمحیط تومور نیز میتوانند تشخیص دهند و به دلیل اندازه کوچک، بهبود خصوصیات رهایش دارو و سمیت سلولی مستقیم، اثرات ضدسرطانی ویژهای اعمال کنند[۳]. این روش براساس اتصال اختصاصی لیگاندهای سطح نانوحاملها، با گیرندههای ویژۀ خود در سطح غشای پلاسمایی سلولهای سرطانی است. با توجه به این که این گیرندهها فقط در سلولهای توموری وجود دارند و یا به میزان خیلی زیادی بیان شدهاند، احتمال رسانش دارو در آنها افزایش یافته است. در واقع هدفگیری فعال نانوذرات در تومور با برقراری اتصال بین لیگاندهای اختصاصی و گیرندههای سطحی تقویت میشود[۹]. بنابراین در نظر گرفتن پارامترهای اساسی مثل وزن مولکولی لیگاند، تمایل اتصالی، ظرفیت و سازگاری زیستی آنها در هنگام طراحی نانوسامانۀ هدفمند با لیگاند فعال، اهمیت ویژهای دارد[۲].
|
کادر آموزشی: به مجموعه فرآیندهای رونویسی از ژن (تبدیل DNA به RNA) و ترجمه آن به پروتئین (تبدیل RNA به پروتئین) ، بیان ژن (Gene Expression) گفته میشود. |
۱-۳- هدفگیری گیرندههای سطحی بیش از حد بیان شده
بعضی از گیرندهها در سلولهای سرطانی در مقایسه با سلولهای طبیعی، بیش از حد بیان شده است. پروتئینهای لکتین به میزان زیادی در سطوح سلولهای سرطانی وجود دارند که به کمک گیرندهها، کربوهیدراتهای خاصی (که میتوانند در سطح نانوحامل پیوند زده شوند) را میتوانند درونی کنند. از طرف دیگر، از لکتینهای موجود در سطح ذرات برای هدف قرار دادن گلیکوپروتئینهای سطحی سلولهای مورد نظر استفاده میشود[۳]. هدف قرار دادن گیرندههای بیش از حد بیان شده، اساس رویکرد هدفگذاری فعال است که منجر به جذب بیشتر و تجمع داروهای ضدسرطان در محل تومور میشود. شکل۲، اهداف خارج سلولی و داخل سلولی ممکن برای هدفگیری فعال عوامل ضدسرطان در درمان سرطان نشان داده شده است[۱۰].

شکل ۴- اجزای داخل و خارج سلولی مورد هدف[۱۰]
۱-۱-۳- هدفگیری گیرندههای فاکتور رشد اپیدرمال [۱](EGFR)
خانواده EGFR شامل چهار نوع گیرنده[۲] HER3، HER2، HER1 و HER4 است و به عنوان یک نوع گیرندۀ پروتئینی سطحی از نوع گیرندههای تیروزین-کینازی، در بسیاری از تومورهای جامد، مانند سرطان روده بزرگ ([۳])، سرطان ریه ([۴])، سرطان سینه، تخمدان و پروستات قرار دارد[۱۰]. فعالیت این گیرندهها با بیان بیش از حد آنها افزایش مییابد و نقش مهمی در پیشرفت تودههای سرطانی دارد. گیرندههای سطحی این سلولها، با جذب آنتیبادیهای متصل به نانوحاملی مثل لیپوزوم به عنوان ایمونولیپوزوم، مورد هدف قرار گرفته و به طور موثری جذب سلولی را افزایش میدهند. نکتۀ قابل توجه درمورد ایمونوحاملها این است که اگر تراکم سطحی آنتیبادیها از حد مناسب فراتر برود، خصوصیات مخفی ماندن نانوذرات از بین رفته و حذف سیستمیک آن از تجمع داروها در محل تومور جلوگیری میکند[۳].
۲-۱-۳- هدفگیری گیرندههای فاکتور رشد فیبروبلاست[۵] (FGFRs)
خانواده FGFR به فاکتورهای رشد فیبروبلاست متصل شده و هر ۴ نوع FGFR3 ،FGFR2 ،FGFR1 و FGFR4، به میزان زیادی در بسیاری از سرطانها مانند پروستات، مثانه، ریه و غیره مشاهده میشوند[۱۰].
۳-۱-۳- هدفگیری گیرندههای فولاتی [۶](FRS)
ویتامین فولیک اسید برای تکثیر سلولهای سرطانی به میزان زیادی مورد نیاز است[۳]. بنابراین گیرندههای فولاتی مانند سایر گیرندههای سطحی، در سلولهای سرطانی مختلفی مانند ریه، سینه و غیره بیش از حد بیان شدهاند[۱۰]. به عنوان مثال، نانوذرات هپارین-پاکلیتاکسل[۷] (داروی ضد سرطان) پیوند یافته به اسیدفولیک در مقایسه با داروی بدون حامل، اثربخشی موثری را در داخل بدن نشان دادند[۳].
۴-۱-۳- هدفگیری گیرندههای ترانسفرین[۸](TfRs)
ترانسفرین (Tf) یک پروتئین حامل آهن پلاسمایی(Fe3) با وزن حدود ۸۰ کیلودالتون است. انواع مختلف گیرندههای ترانسفرین TfRs، در سطح سلولها وجود دارند. مجموعه Tf-TfR با فرآیند آندوسیتوز درونی میشود تا از جذب بیشتر از حد مورد نیاز آهن جلوگیری شود. با توجه به افزایش تقاضای آهن توسط سلولهای سرطانی، گیرندههای ترانسفرین در سلولهای سرطان بیش از حد بیان شدهاند. بنابراین لیپوزومهای حاوی دوکسوروبیسین با هدف TfR فعالیت درمانی سرطان کبد را به میزان قابل توجهی بهبود میبخشند. همچنین در مطالعهای دیگر، لیپوزومهای TfR هدفمند با ترانسفرین به همراه داروی ضدسرطان Docetaxel محصور شده در مقایسه با لیپوزومهای غیرهدفمند، سمیت سلولی بیشتری از خود نشان دادند[۱۰].
۲-۳- هدفگیری گیرندههای داخل سلولی
علاوهبر گیرندههای سطح غشای پلاسمایی، برخی از اجزای داخل سلولی نظیر پروتئینهای گیرندۀ هستهای یا آنزیمهای مسیرهای بیوشیمیایی سیتوپلاسمی که به میزان زیادی در سلولهای سرطانی فعال هستند نیز میتوانند مورد هدف نانوسامانههای درمانی قرار بگیرند[۱۰].
۳-۳- هدفگیری اندامکهای سلولی
بعضی از روشهای درمانی نیازمند رسانش دقیقتر دارو در سطح اندامکهای داخل سلولی مثل هسته، لیزوزوم، میتوکندری یا شبکه آندوپلاسمی است. با تحویل دارو به داخل سلول، پاسخ درمانی افزایش یافته و عوارض سمی آنها به حداقل میرسد[۲]. اگر هدف سامانه، تحویل بعضی ماکرومولکولها (DNA، siRNA یا پروتئینها) به داخل سلول باشد، گیرندههای هدف باید به گونهای باشند که فعال شدن آنها در جذب سلولی نانوحاملها نقش داشته باشد[۳].
۱-۳-۳- هدفگیری هسته
در صورت تحویل ژنهای درمانی، اندامک مورد هدف، هسته سلولی است تا با اصلاح ژنهای ناکارآمد یا حذف شده، اثرات ترمیمی خود را اعمال کند. از طرف دیگر، هستۀ سلولهای سرطانی را میتوان برای اعمال اقدامات تخریبی در مادۀ ژنتیکی مورد هدف قرارداد تا از تکثیر سلول جلوگیری شود. در واقع، مکانیسم عملکرد بیشتر داروهای ضدسرطان مثل دکسوروبیسین[۹]، شامل آسیب اکسیداتیو DNA و مهار آنزیم [۱۰] توپوایزومرازII در هسته است. با این وجود، اگر این داروها به طور مشخص برای ورود به سلول و همچنین هسته سلول هدف قرار نگیرند، تأثیر چنین داروهای ضدسرطان به طرز چشمگیری کاهش مییابد[۲].
رسانش هستهای نیازمند مقابله با چندین مانع سلولیمولکولی مهم مثل عبور از غشای سلولی، جلوگیری از تخریب لیزوزومی و ورود به هسته است. پوشش هستهای دارای مجموعه منافذی است که ارتباط بین سیتوزول و هسته را به شدت کنترل میکند. بنابراین تحویل هدفمند هستهای از جهت انتخاب ماهیت شیمیایی و اندازۀ مناسب نانوذرات جهت عبود از منافذ هسته، به یک کار چالشبرانگیز تبدیل شدهاست. هدفگیری هسته با پروبهای تصویربرداری مختلف مانند نانوذرات مغناطیسی، نانوذرات طلا، نانوذرات نقره و نقاط کوانتومی، تا کنون مورد بررسی قرار گرفته است. از این میان، نانوذرات طلا با توجه به سنتزآسان، اندازۀ قابل کنترل و بسیار کوچکی که به آنها اجازه میدهد تا به ابعادی پایینتر از منافذ هستهای برسند و به دلیل ماهیت شیمیایی آن که اصلاح سطحی را سادهتر میکند، برای رسانش هستهای بهتر عمل میکنند[۲].
۲-۳-۳- هدفگیری لیزوزوم
گروه سرامیدها (یک اسفنگوزین و یک اسید چرب) بر روی نانوسامانههای حمل دارو، باعث افزایش نفوذپذیری در غشای لیزوزوم میشوند. بر اساس مطالعات، تحویل سرامیدها به لیزوزوم، با استفاده از لیپوزومهای اصلاح شده با ترانسفرین، میزان مرگ سلولی در سلولهای سرطانی را افزایش داده است[۱۰].
۳-۳-۳- هدفگیری میتوکندری
لیپوزومهایی که دارای تریفنیل فسفونیوم[۱۱](TPP) به عنوان لیگاند در سطح خود هستند، میزان انتقال بار دارویی به میتوکندری را به طور مؤثری افزایش میدهند. مطالعات نشان داده است که لیپوزومهای حاوی داروی پاکلیتاکسل متصل به لیگاندTPP، با هدف قرار دادن میتوکندری، در مقایسه با لیپوزومهای غیرهدفمند، سمیت سلولی را افزایش میدهند. اخیراً، لیپوزومهایی با عملکرد دوتایی (با استفاده از پاسخ به pH و هدف قرار دادن میتوکندری) در درمان سلولهای سرطانی A549 و سلولهای سرطانی مقاوم به دارو A549، گزارش شده است. بر اساس نتایج، بهکارگیری لیپوزومهایی با عملکرد دوگانه، یک روش جدید را برای امکان درمان سرطانهای مقاوم به دارو فراهم میکند[۱۰].
۴- هدفگیری ریزمحیط سلول سرطانی
شرایط هیپوکسی (کم اکسیژنی) به دنبال سرعت بالای تقسیم سلولی در بافت تومور، شرایط متابولیسم داخل سلولی را به سمت گلیکولیز با تشکیل اسید لاکتیک سوق میدهد. سلولهای سرطانی برای جلوگیری از تجمع اسیدلاکتیک و مرگ سلولی، با بیان بیش از حد پمپها و ناقلهای پروتئینی، پروتونها را از سیتوزول به محیط خارج سلولی منتقل میکنند. بنابراین ریزمحیط بافتهای تومور (pH =۶/۵-۷/۰) نسبت به بافتهای نرمال (pH =۷/۴) اسیدیتر است. در مطالعات اخیر، لیپوزومهای حساسبه pH، برای افزایش پنجرۀ درمانی دوکسوروبیسین در معالجه سرطان سینه مورد استفاده قرار گرفتهاند[۲].
۱-۴- هدفگیری عروق سرطان
روش دیگر، هدف قراردادن گیرندههای بیش از حد بیان شده در ریزمحیط سلولها و عروق توموری است. تشکیل رگهای خونی جدید برای تأمین اکسیژن و مواد مغذی جهت رشد تومور ضروری است. از بین رفتن عروق یک سرطان باعث کاهش رشد سلولهای سرطانی میشود. بر خلاف تأثیر EPR، مهمترین مزیت هدفگیری عروق در این واقعیت است که راندمان اثرگذاری آن با خاصیت نفوذپذیری رگهای خونی یا جذب سلول ارتباطی ندارد. هدفگیری عروق میتواند تحویل ضعیف داروها و مقاومت دارویی را محدود کند و میتواند با ناهمگنی تومور یا انواع مختلف تومورها سازگار باشد[۲]. در شکل ۵، تعدادی از گیرندهها در ریزمحیط زیست تومور بیش از حد بیان شدهاند که میتوانند برای تحویل کارآمد داروهای ضدسرطان در محل لازم مورد هدف قرار بگیرند، نمایش داده شده است[۱۰].
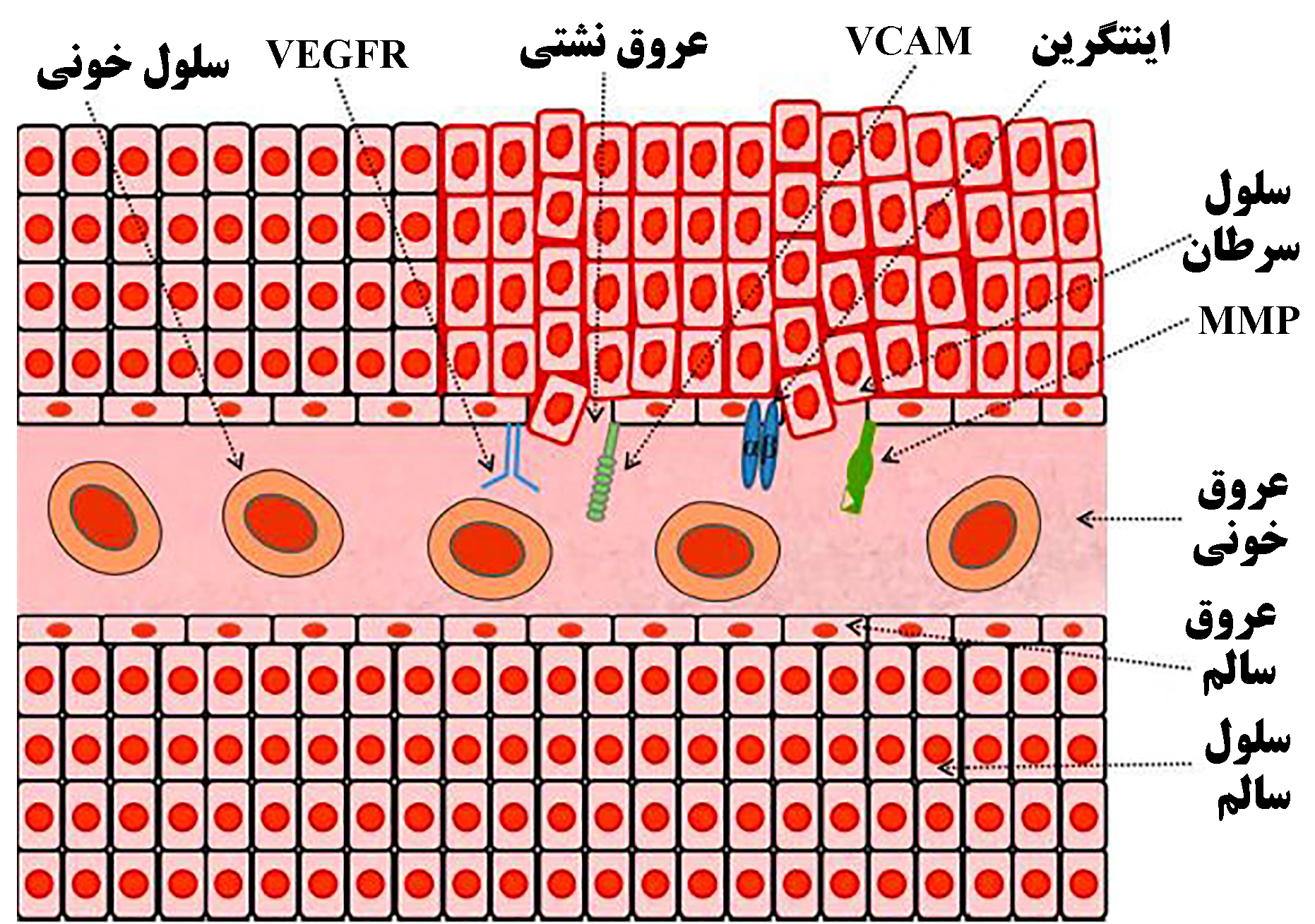
شکل ۵- اهداف ریزمحیط و عروق تومور[۱۰]
۱-۱-۴- هدفگیری مولکولهای چسبندگی سلولهای عروقی
با افزایش رگزایی، بیان مولکولهای چسبندگی بین سلولهای پوششی عروقی (اندوتلیال) نیز افزایش مییابد. برای مثال [۱۲] (در روند التهاب نقش دارد)، CD44 (درسرطان سینه و روده بزرگ به میزان زیادی بیان شده است) به خوبی میتوانند مورد هدف قرار بگیرند[۱۰].
۲-۱-۴- هدفگیری اینتگرینها
اینتگرینها، گلیکوپروتئینهای عرض غشایی هستند که بیش از حد در سلولهای اپیتلیال جدید عروق توموری بیان میشوند. یک تریپتید [۱۳] (شامل توالی اسیدآمینهای آرژنین، گلیسین، آسپارتات) تمایل اتصال شدیدی به اینتگرینها دارد. لیپوزومهای همراه با RGD برای هدف قرار دادن اینتگرینها آماده میشوند. لیپوزومهای متصل بهRGD با داشتن پاکلیتاکسل محصور شده، تجمع داروی بیشتری در سلولهای تومور، نسبت به لیپوزومهای غیرهدفمند دارای پاکلیتاکسل نشان دادند. لیپوزومهای دوکسوروبیسین که با RGD همراه بودند، جذب سلولي بالاتري دارو را در رده سلولهای سرطانی U87MG در مقايسه با ليپوزومهاي دوکسوروبيسين ساده نشان دادند[۱۰]. به همین شکل، نانوذرات آهن متصل پپتید RGD، به منظور هدایت به سمت عروق آسیب دیده کاروتید و آنوریسم[۱۴] (برآمدگی دیواره) آئورت به کار گرفته شدهاند[۱۱]. در جدول (۱) مثالهایی از نانوسامانههای هدفگیری به روش فعال ارائه شده است.
جدول ۱- مثالهای نانوسامانههای هدفگیری به روش فعال[۳]
|
نوع نانوحامل |
دارو |
لیگاند مورد هدف |
بافت مورد هدف |
|
لیپوزوم |
Daunorubicin |
Transferrin |
گلیوماC6 |
|
Oxaliplatin |
Transferrin |
مدل کارسینومای کولون |
|
|
Doxorubicin |
Folate |
کارسینومای KB انسان |
|
|
Doxorubicin, epirubicin, vinorelbine |
Anti-EGRF MAb |
گلیوما U87 |
|
|
میسل پلیمری |
Paclitaxel |
RGD-peptide |
سرطان سینه MDA-MB-435 |
|
نانوذرات |
Docetaxel |
A10 RNA aptamer |
سرطان پروستات LNCaP |
۴- جمعبندی و نتیجهگیری
قوانین هدفگیری فعال درمورد همۀ شرایط و انواع مختلف تومورها صدق نمیکند. زیرا: (۱) تراکم گیرندهها بر روی سطوح سلول، در زمانهای مختلف و بسته به نوع تومور، متفاوت است. برهمکنش لیگاند با گیرنده فقط در سلولهایی با تراکم بالا درگیرندههای سطحی رخ میدهد و با فراهم کردن امکان عبور نانوذرات، باعث افزایش نفوذ به سلول میشوند. (۲) از طرف دیگر، با توجه به این که هرچقدر تراکم لیگاندهای سطحی بیشتر باشد، بازدهی هدفمندی بالاتر میرود؛ اما از طرف دیگر ممکن است با ایجاد ممانعت فضایی اثرات متضادی نشان بدهد. (۳) سومین پدیدهای که باید به آن توجه شود افزایش بالقوه احتمال اوپسونیزاسیون[۱۵] نانوذرات ناشی از حضور لیگاندهای سطحی است. (۴) سرانجام، وابستگی خاصی بین برخی از لیگاندها مثل اسیدفولیک و کبد وجود دارد که میتواند باعث جذب کبدی زودرس نانوساختارهای متصل به اسیدفولیک شود. بنابراین با درنظرداشتن اصول طراحی یک سامانۀ حمل دارو باید توجه کرد که بسیاری از سامانههای حمل داروی هدفگیری با روش فعال، درشرایط آزمایشگاهی بسیار مؤثر عمل میکنند، در حالی که ممکن است در هنگام تجویز به داخل بدن، تجمع دارو در تومورها را تقویت نکنند.
۵- مراجع
[1]Nag, Okhil K., and James B. Delehanty. "Active Cellular and Subcellular Targeting of Nanoparticles for Drug Delivery." Pharmaceutics 11.10 (2019): 543.
[2]Attia, Mohamed F., et al. "An overview of active and passive targeting strategies to improve the nanocarriers efficiency to tumour sites." Journal of Pharmacy and Pharmacology 71.8 (2019): 1185-1198.
[3]Hirsjarvi, Samuli, Catherine Passirani, and Jean-Pierre Benoit. "Passive and active tumour targeting with nanocarriers." Current drug discovery technologies 8.3 (2011): 188-196.
[4]Salim, Malinda, et al. "Amphiphilic designer nano-carriers for controlled release: from drug delivery to diagnostics." MedChemComm 5.11 (2014): 1602-1618.
[۵] سید محمدجواد حسینی زاده. "مروری بر مهمترین مکانیسمها و سیستمهای دارورسانی هدفمند". فصلنامه بیولوژی کاربردی, ۶, ۲۱, ۱۳۹۵, ۱۷-۲۸.
[6]Zhang, Rui Xue, et al. "Design of nanocarriers for nanoscale drug delivery to enhance cancer treatment using hybrid polymer and lipid building blocks." Nanoscale 9.4 (2017): 1334-1355.
[7]Yoo, Jihye, et al. "Active targeting strategies using biological ligands for nanoparticle drug delivery systems." Cancers 11.5 (2019): 640.
[8]Huynh, Ngoc Trinh, et al. "The rise and rise of stealth nanocarriers for cancer therapy: passive versus active targeting." Nanomedicine 5.9 (2010): 1415-1433.
[۹] فاطمه وطنزاده، فرشته رضایی، مهدی قلعه جیعی پور. نانوذرات در دارورسانی هدفمند و درمان سرطان، دومین کنفرانس بینالمللی مهندسی برق، اردبیل، ۱۳۹۶, ۳۵-۴۲
[10]Riaz, Muhammad, et al. "Surface functionalization and targeting strategies of liposomes in solid tumor therapy: A review." International journal of molecular sciences 19.1 (2018): 195.
[۱۱] آزاده حائری، شهرام ربانی، آرش محیوبی، کاربرد نانوذرات در بیماریهای قلبی-عروقی، مجله علوم پزشکی رازی، دوره۲۵، شماره۱۶۶، فروردین۱۳۹۷، صفحۀ ۳۴-۴۵
۶- پاورقی
[1]Epidermal growth factor receptor
[2] human epidermal growth factor receptor
[3]Colorectal cancer
[4]Non-small-cell lung carcinoma
[5]fibroblast growth factor receptors
[6]Folate receptors
[7]Paclitaxel
[8]Transferrin receptors
[9] Doxorubicin
[10]Topoisomerase II
[11] Triphenylphosphonium
[12]vascular cell adhesion molecule
[13]Arg-Gly-Asp
[14]Aneurysm
[15]opsonisation