پنجشنبه 18 دی 1399 کد خبر: 76

۱-مقدمه
روشهای سنتی تصفیه پساب، توانایی حذف برخی آلایندههای آلی، معدنی و فلزات سنگین را ندارند. همچنین این روشها نیاز به فضای زیادی دارند و هزینههای بالایی را به دنبال خواهند داشت. نانوساختارها به دلیل سطح ویژه بالا که ناشی از اندازه کوچک آنهاست، قابلیت زیادی در جذب آلایندهها دارند. بعلاوه فیلترهای تولید شده با منافذ در ابعاد نانو، توانایی ممانعت از عبور کوچکترین آلایندهها را دارند. در مقاله قبل، روش تصفیه پساب با استفاده از فوتوکاتالیستها مورد بررسی قرار گرفت. در این مقاله به بررسی نانوجاذبها و روشهای نانوفیلتراسیون پرداخته خواهد شد.
۲- نانوجاذبها[۱]
جذب[۲] فرایندی است که در آن یک ماده طی برهمکنشهای فیزیکی یا شیمیایی به ماده دیگری به نام جاذب، جذب میشود. جاذبها معمولا در تصفیه و خالصسازی آب برای حذف آلایندههای آلی و معدنی از پساب مورد استفاده قرار میگیرند. به طورکلی فرایند جذب آلایندهها بر روی سطح جاذب در سه مرحله اتفاق میافتد.
نانوذرات دو خاصیت مهم دارند که آنها را به جاذبهای مفیدی تبدیل میکند. نانومواد سطح ویژهی بیشتری نسبت به مواد بالک دارند و میتوان آنها را با گروههای عاملی متنوع عاملدار نمود تا به طور انتخابی آلایندههای موردنظر را جذب کنند. بعلاوه، نانوجاذبها تخلخلهای نانومقیاس دارند که به جذب آلایندهها کمک شایانی میکند. همچنین میتوان آلایندهها را از نانوجاذبها جداکرده و مجددا از آنها استفاده کرد یا به عبارتی دیگر آنها را بازیابی نمود. برای مثال مشاهده شده است که نانوساختارهای خودآرایی شده اکسید آهن توانایی جذب یونهای فلزات سنگین و رنگهای آلی موجود در پساب را دارند [۱]. از آنجا که نانوذرات میتوانند خاصیت مغناطیسی داشته باشند، میتوان به راحتی آنها را با استفاده از روش جداسازی مغناطیسی از آب خارج کرد و با استفاده از احتراق کاتالیستی[۳] در دمای ۳۰۰ درجه سلسیوس جاذب مغناطیسی را بازیابی کرد. احتراق کاتالیستی فرایندی است که طی آن با دادن حرارت کافی به سیستم، کاتالیست قادر است ماده مورد نظر را اکسید کند.
در ادامه به برخی از جاذبهای متداول اشاره شده است.
۱-۲- نانوجاذبهای کربنی
نانومواد کربنی به طور گسترده برای جذب آلایندههای آلی و معدنی موجود در پساب مورد استفاده قرار گرفتهاند. جدا از این نانومواد، کربن فعال[۴] به دلیل ظرفیت جذب بالا، پایداری حرارتی بالا، مقاومت بالا نسبت به هدررفت سایشی و هزینه کم معروفترین ماده برای جذب آلایندههاست. از کربن فعال گرانولی برای حذف آلایندههای آلی متنوع و مواد متعفن از آب استفاده شده است[۲]. در پژوهشی جذب بنزن و تولوئن از پساب صنعتی با استفاده از کربن فعال مورد بررسی قرار گرفته و ظرفیت جذب ۴۵۰ میلیگرم بنزن بر گرم آب و ۷۰۰ میلیگرم تولوئن بر گرم آب گزارش شده است[۳]. همچنین مشاهده شده است که کربن فعال توانایی جذب یون فلزات سنگین مانند جیوه، نیکل، کبالت، کادمیوم، مس، سرب و کروم ۳ و۴ ظرفیتی را نیز دارد[۴].
نانولولههای کربنی گروه دیگری از نانوجاذبهای کربنی هستند. به دلیل سطح ویژهی زیاد و پایداری شیمیایی و حرارتی بالا و به طور خاص، قابلیت عاملدارکردن سطح نانولولههای کربنی، این نانوساختارها یکی از قویترین جاذبها به شمار میروند[۵]. در پژوهشی جذب ۲-دیکلرو بنزن به همراه سرب و کادمیوم از آب مورد بررسی قرار گرفت. جذب این آلایندهها وابسته به مورفولوژی و وضعیت سطح نانولولههای کربنی است[۶]. نقصها و پستی بلندیهای سطح نانولولههای کربنی برای جذب بهتر آلایندهها لازم است[۷]. در شکل ۱ تاثیر عملیاتهای مختلف و عاملدار شدن بر روی میزان جذب نانولوله نشان داده شده است. هنگامی که عوامل سطحی قطبی بر روی نانولوله قرار میگیرند، آلایندههای آلی دوقطبی با بازده بیشتری جذب میشوند. در صورتی که از نانولوله عاملدار نشده برای جذب استفاده شود، آلایندههای دوقطبی با بازده کمتری جذب میشوند اما بازده جذب آلایندههای غیرقطبی افزایش مییابد.
نرخ جذب و ظرفیت جذب نانولولههای کربنی و کربن فعال بالاست و هردو از پایداری شیمیایی و حرارتی بالایی برخوردارند که آنها را برای تصفیه پساب مناسب میسازد. با این وجود، جدایش کامل نانولولههای کربنی و پودر کربن فعال از آب به دلیل اندازه بسیار کوچک آنها دشوار است. برای حل این مشکل میتوان از نانوذرات مغناطیسی با نانولولههای کربنی یا کربن فعال استفاده کرد و آنها را به سادگی با استفاده از میدان مغناطیسی از آب خارج نمود[۸].
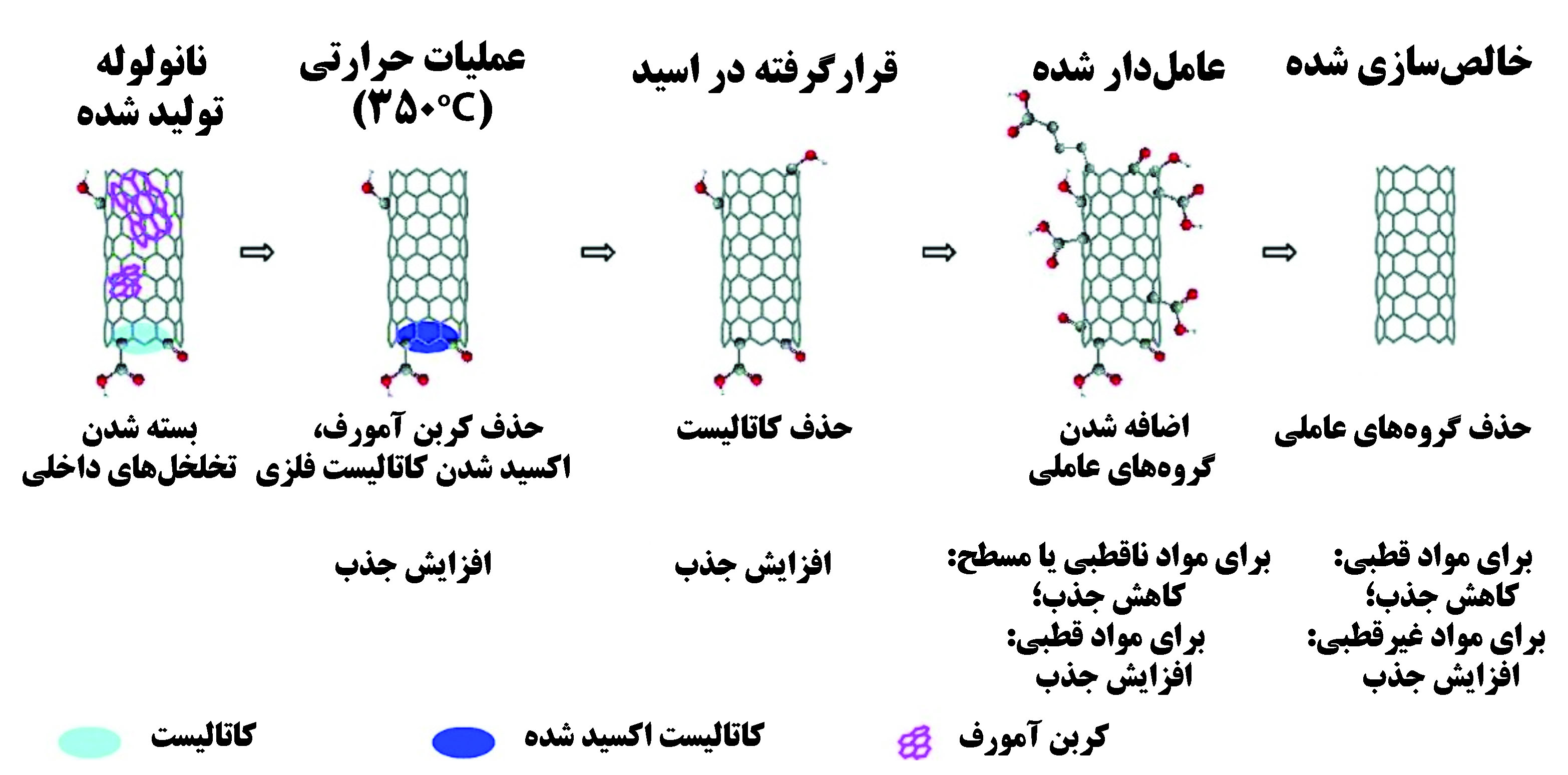
شکل۱- تاثیر عملیاتهای مختلف و عاملدارکردن نانولوله بر روی جذب آن[۴۳]
۲-۲- جاذبهای زیستی
در برخی پسابها مشاهده میشود که آلایندههای آلی با غلظت پایین در حد پیکوگرم یا نانوگرم بر لیتر را نمیتوان به طور کامل از آب حذف کرد]۹[. برای حذف این آلایندهها، جاذبهای زیستی که از مواد بیولوژیک مشتق میشوند موثر هستند. جاذبهای زیستی خواص مفیدی دارند ازجمله هزینه پایین، بازده بالا، عدم نیاز به افزودن ماده مغذی و قابلیت بازیابی. درپژوهشی از یک زمینه دیانای (DNA) برای حذف انتخابی مشتقات دیوکسین استفاده شد. بازیابی زمینه دیانای به سادگی و با شستشو توسط هگزان انجام میشود[۱۰]. تحقیقات متعددی بر روی زیستجاذبهای حاوی تریولین[۵] برای حذف آلایندههای آلی انجام شده است[۱۱]. مزیت استفاده از جاذبهای حاوی تریولین ظرفیت جذب بالای آن و انحلال و نفوذپذیری پایین به دلیل جرم مولکولی بالای آن است.
جاذبهای زیستی برای حذف یونهای فلزات سنگین نیز استفاده میشوند. جاذبهای پایه کیتوسان[۶] بازده بالایی در جذب فلزات سنگین از خود نشان دادهاند. جذب فلزات در کیتوسان از طریق واکنش کِیلِیت[۷] شدن روی گروههای آمینواسید کیتوسان انجام میشود[۱۲]. کیلیت شدن واکنشی است که در آن مولکولها با یونهای فلزی پیوند برقرار میکنند. این واکنش شامل تشکیل دو یا چند پیوند داتیو مجزا بین یک لیگاند و یک اتم است. به این لیگاندها کیلیت یا عوامل کیلیت شدن[۸] میگویند.
۳-۲- نانوجاذبهای اکسیدفلزی
اکسیدهای متداولی که به عنوان جاذب استفاده میشوند عبارتند از اکسیدهای آهن، منگنز، سیلیسیم، تیتانیوم و تنگستن. مانند سایر جاذبها از مزایای کم هزینه بودن و قابلیت عاملدار شدن برای جذب هدفمند برخوردارند. نانوجاذبهای پایه اکسیدآهن میتوانند برای حذف آلایندههای متعدد آلی از پساب مورد استفاده قرار گیرند[۱۳]. به دلیل خواص مغناطیسی نانوذرات اکسیدآهن، نانوجاذبهای برپایه آن را میتوان به راحتی با استفاده از میدان مغناطیسی از فاز مایع جداسازی کرد[۱۴].
از نانوجاذب لایهای (هیدروکسید آلومنیوم-روی) برای حذف آلایندههای آلی از پساب شرکتهای نساجی که عمدتا شامل رنگهای آلی هستند میتوان استفاده کرد[۱۵]. بازده جذب یونهای سرب بیش از آنکه تابع رفتار الکترواستاتیک نانوجاذبها باشد، متاثر از فعل و انفعالات شیمیایی است. از این رو اکسیدهای منگنز درمقایسه با اکسیدهای آهن، بازده جذب بالاتری از سرب را نشان میدهند.[۱۶]. همینطور درباره جذب یوروپیوم توسط نانوذرات اکسید آلومینیوم، جذب این نانوذرات شدیدا وابسته به مقدار pH بوده و مستقل از قدرت یونی است[۱۷].
۴-۲- زئولیتها[۹]
زئولیتها سطح ویژه بالا و ظرفیت تبادل یونی بالایی دارند که آنها را به جاذبی قوی برای تصفیه آب تبدیل میکند. اکثر زئولیتها طبیعی هستند و همچنین میتوان آنها را بصورت تجاری نیز تولید نمود. در پژوهشی از زئولیت اصلاح شده با هگزادسیلتریمتیلآمونیوم[۱۰] برای جذب مشتقات فنولی در آب استفاده شد. مولکولهای HDTMA در سطح زئولیت تشکیل یک لایه دوگانه مایسلی میدهند و منجربه افزایش ظرفیت جذب زئولیت میشوند[۱۸]. در پژوهشی دیگر از زئولیت اصلاح شده با آمیزهای از باکتریها برای تجزیهی پیریدین[۱۱] و کوئینولین[۱۲] استفاده شد. تجزیه زیستی این دو ماده منجر به تولید یون آمونیوم در آب میشود که توسط زئولیت جذب میشود. بنابراین تجزیهی پیریدین و کوئینولین و به طور همزمان جذب آمونیوم در زئولیتهای اصلاح شده با باکتریها رخ میدهد[۱۹].
از زئولیتها برای جذب یونهای فلزات سنگین نیز استفاده میشود. در پژوهشی جذب سرب و کادمیوم با استفاده از دو زئولیت طبیعی کابازیت[۱۳] و کلینوپتیلولیت[۱۴] مورد بررسی قرار گرفت. با استفاده از این دو زئولیت که قبل از فرایند جذب در محول سدیم هیدروکسید قرار گرفتند، سرب و کادمیوم تا ۹۹ درصد از پساب حذف شدند[۲۰]. تخلخل بالای زئولیتها باعث افزایش ظرفیت جذب آنها میشود؛ و خاصیت فوتوکاتالیستی برخی از آنها به کاهش ظرفیت بالای فلزات سنگین و کاهش سمیت آنها کمک میکند.
۵-۲- نانوذرات آهن صفرظرفیتی[۱۵]
نانوذرات آهن صفرظرفیتی مادهای است که برای حذف انواع آلایندههای آلی و معدنی از آب مورد استفاده است. به دلیل انرژی سطحی بالای این نانوذرات، به شدت واکنشپذیر و ناپایدار هستند. به همین دلیل روشهای متعددی برای افزایش پایداری آنها مورد مطالعه قرار گرفته است؛ مانند اصلاح سطحی این نانوذرات، تشکیل امولسیون از این نانوذرات برای بهبود امتزاجپذیری، تشکیل ترکیب بین فلزی برای واکنشپذیری بهتر و قرار گرفتن بر روی بستر کربنی برای پخش یکنواخت در مایع. نانوذرات آهن صفرظرفیتی میتوانند یون فلزات سنگین مانند مس و نقره را احیا کنند و همچنین قادرند برخی از آنان مانند روی و کادمیوم را مستقیما جذب سطحی کرده و تحرک آنها را از بین ببرند. بعلاوه خاصیت مغناطیسی این نانوذرات به جدایش آسان آنها از سیال کمک میکند. نانوذرات آهن صفرظرفیتی توانایی بالایی در جذب و رسوبدهی یونهای آرسنیک ۳ و ۵ ظرفیتی از خود نشان میدهند. جذب این یونها از طریق برهمکنش ضعیف الکترواستاتیک بین یونها و مکانهای اتصال روی نانوذره است[۲۱]. در پژوهشی از نانوذرات آهن صفرظرفیتی کپسوله شده در کیتوسان برای حذف آرسنیک از پساب استفاده شده است و مشاهده شده که در طیف وسیعی از pH (از ۲ تا ۹)، آنیونهایی مانند سولفات، فسفات و سیلیکات تاثیری در قدرت جذب آرسنیک بر روی نانوذرات آهن صفرظرفیتی ندارند و آرسنیک تقریبا به طور کامل از پساب حذف میشود[۲۲]. به جز آرسنیک، نانوذرات آهن صفرظرفیتی برای حذف یون فلزات مختلف از پساب مانند کروم، مس، سرب، باریم و کبالت استفاده میشود. بعلاوه این نانوذرات توانایی حذف یا بازیابی یون فلزات حل شده در پساب مانند کروم ۶ظرفیتی یا اورانیوم ۶ظرفیتی را دارند[۲۳] و همچنین در برابر سایر آلایندههای آلی و معدنی موثر واقع میشوند. در شکل ۲ جذب نیتروبنزن بر روی کربن مزومتخلخل، نانوذرات آهن صفرظرفیتی و کامپوزیت این دو ماده مقایسه شده است. در (پ) مشخص است که کامپوزیت این دو ماده نسبت به هرکدام از آنها عملکرد بهتری در جذب نشان داده است.
۶-۲- هیدروژلها[۱۶]
هیدروژلها جاذبهای بسیار قوی برای حذف فلزات سنگین از پساب هستند. قدرت جذب بالای آنها به دلیل شبکه سه بعدی و قابلیت قرار گرفتن گروههای عاملی متنوع بر روی آنهاست[۲۴]. هیدروژلها توانایی جذب مقدار زیادی آب را دارند؛ به دلیل خواص ذاتی از جمله اتصالات عرضی میان زنجیرههای شبکه، انعطافپذیری زنجیرهها و حجم آزاد بالا. با این وجود مشکل اصلی استفاده عملی از هیدروژلها، استحکام مکانیکی پایین این مواد است. برای حل این مشکل میتوان از اضافه کردن ترکیبات آبگریز به ساختار هیدروژل استفاده کرد[۲۵].
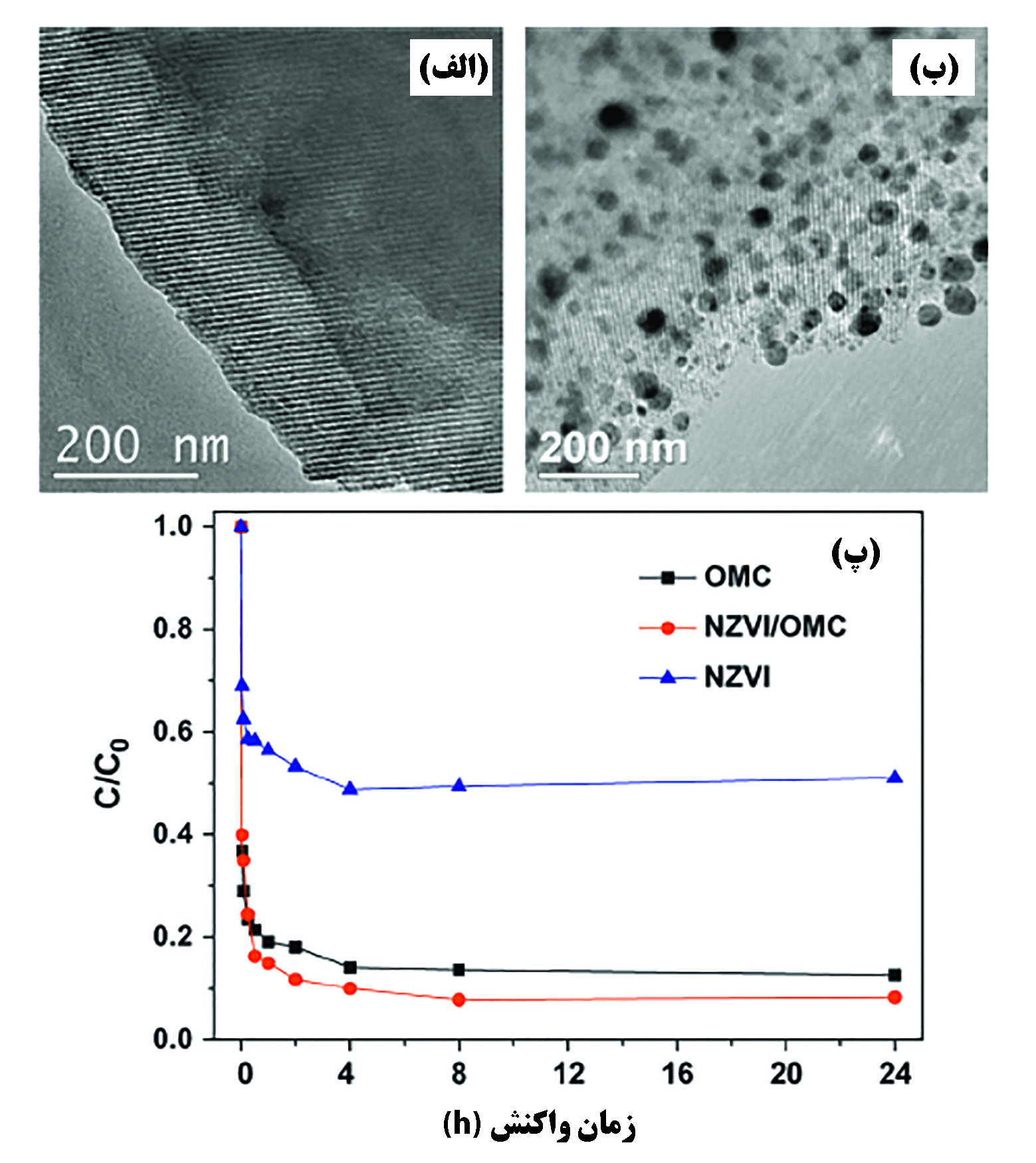
شکل۲- الف) تصویر میکروسکوپ الکترون عبوری کربن مزومتخلخل و ب) کامپوزیت کربن مزومتخلخل و نانوذرات آهن صفرظرفیتی پ) نسبت غلظت آلاینده به غلظت اولیه بر حسب زمان برای هر کدام از جاذبها[۲۳]
برای حذف یون فلزات سنگین از پسابها میتوان از نانوکامپوزیتهای پلیمری در قالب هیدروژل استفاده کرد. این نانوکامپوزیتها توانایی متورم شدن در محیط آبی را دارند و بنابراین ظرفیت جذب بالایی را خواهند داشت[۲۶]. هیدروژلهای تشکیل شده از آکریلیک، وینیلیک و سایر گروههای مونومری مانند آکریلیک اسید، آکریل آمید، هیدروکسیل اتیل متااکریل آمید، وینیل پیریدین و ... برای جذب فلزات سنگین و برخی دیگر از گونههای حل شونده، بازده بالایی از خود نشان دادهاند[۲۷]. در پژوهشی ابرجاذب هیدروژلی (NIPAAm/DAPB/AA) آمفوتری با استفاده از فرایند میکروامولسیون معکوس سنتز شدند و توانستند یونهای سرب و جیوه دوظرفیتی را از آب حذف کنند. نانوذرات هیدروژل استفاده شده اندازه ۳۰ تا ۴۰ نانومتری داشتند و همچنین مشاهده شده است که بازده جذب یونهای سرب بیشتر از جذب یونهای جیوه برای این نوع از هیدروژل است[۲۸].
۳- نانوفیلتراسیون[۱۷]
فیلتراسیون یکی از متداولترین و مهمترین گامها در تصفیه آب و پساب است که با استفاده از یک فیلتر یا غشا، بخش جامد را از مایع جدا میکند. نانوفیلتراسیون یک تکنیک جداسازی غشایی است که نیروی محرکه آن را فشار تامین میکند. این روش درحال گسترش برای تصفیه آب و پساب است؛ زیرا قابلیت دفع مواد براساس بارالکتریکی و نرخ تراوایی بالایی دارد. با توجه به اینکه در مقایسه با فرایند اسمز معکوس(۲۰ تا ۱۰۰ اتمسفر)، فشار کمتری برای نانوفیلتراسیون لازم است(۷ تا ۳۰ اتمسفر)، این روش به دلیل بهینه بودن به لحاظ مصرف انرژی مورد استقبال قرار گرفته است[۲۹].
ویژگیهای غشای استفاده شده در نانوفیلتراسیون مابین غشای غیرمتخلخل اسمز معکوس و غشای متخلخل اولترافیلتراسیون قرار دارد. همچنین عبور مواد از غشا در فرایند نانوفیلتراسیون از طریق مکانیزم نفوذ محلول صورت میگیرد. بعلاوه، برخی غشاهای نانوفیلتراسیون بار سطحی ثابتی دارند که منجر به فیلتراسیون انتخابی ترکیبات، در کنار فیلتراسیون فیزیکی میشوند. فرایند کاهش سختی آب با استفاده از نانوفیلتراسیون بهطور شماتیک در شکل۳ نشان داده شده است. اندازه تخلخلهای غشای نانوفیلتراسیون بسیار کوچک (معمولا بین ۱ تا ۵ نانومتر) هستند و اکثر حلشوندهها به طور موثری توسط غشا جداسازی میشوند. با این حال، بارسطحی غشا به یونهای تک ظرفیتی موجود در آب سخت اجازه عبور از فیلتر را میدهد در حالیکه یونهای چندظرفیتی باقی میمانند. برای گونههای بدون بار الکتریکی، مکانیزم محدودیت اندازه غالب است و ذرات بر اساس اندازه شان میتواند از غشا عبور کنند؛ اما در گونههای باردار، هردو مکانیزم محدودیت اندازه و برهمکنش الکترواستاتیک وجود دارند[۳۰]. امروزه از تکنیک نانوفیلتراسیون برای تصفیه پساب در صنایع مختلفی همچون نساجی، داروسازی، صنایع لبنی، پتروشیمی و ... استفاده میشود. به دلیل مکانیزم منحصربفرد و در دسترس بودن انواع غشاها، نانوفیلتراسیون برای حذف اکثر آلایندههای آلی و معدنی میتواند مورد استفاده قرار بگیرد. در ساخت غشاهای نانوفیلتراسیون معمولا از پلیمرها استفاده میشود؛ زیرا روش تهیه آنها آسان است، انعطافپذیری آنها بالاست و هزینه آن پایین است. اما غشاهای پلیمری پایداری شیمیایی پایین و عمر کوتاهی دارند[۳۱]. درسوی دیگر، غشاهای ساخته شده از سرامیکهای معدنی پایداری شیمیایی و حرارتی بالاتر و درنتیجه عمر بیشتری دارند اما عیب آنها هزینهی بالای تولید و کمبود انعطاف است. نانومواد میتوانند در تولید غشاهای نانوفیلتراسون نقش موثری ایفا کنند؛ به طوریکه هزینه تولید غشا را کاهش داده و انعطاف آن را افزایش دهند. در ادامه کاربرد برخی نانوساختارها در فرایند نانوفیلتراسیون شرح داده شده است.
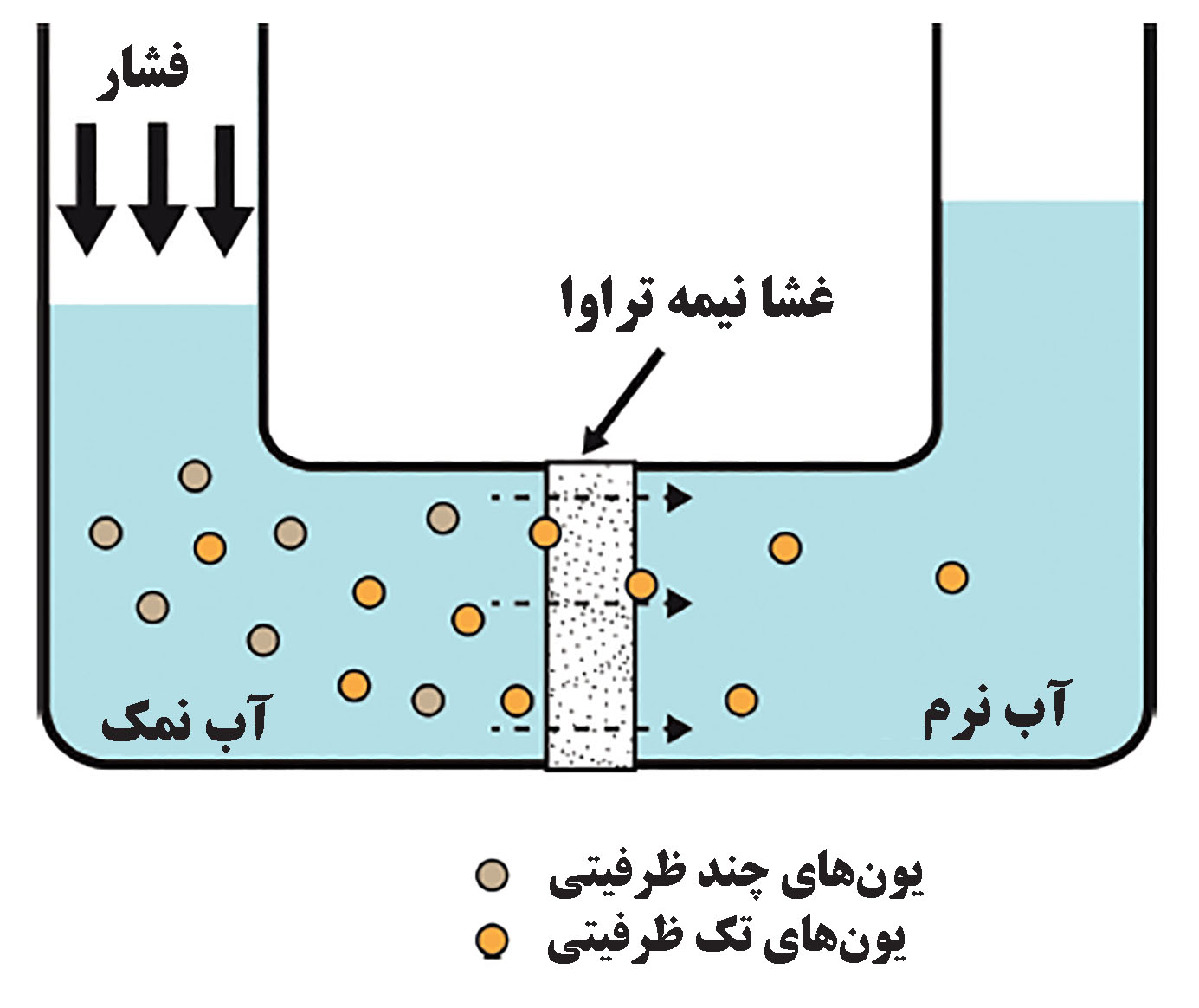
شکل ۳- فرایند کاهش سختی آب[۴۴]
۱-۳- نانوساختارهای کربنی
نانوساختارهای کربنی به دلیل سادگی تولید، پایداری مکانیکی زیاد و توانایی بالا در جلوگیری از عبور آلایندهها[۱۸]، در بسیاری از غشاها مورد استفاده قرار گرفتهاند. غشاهای مبتنی بر نانولولههای کربنی تراوایی بالا و همچنین نرخ بالا در جلوگیری از عبور آلایندهها[۱۹] دارند[۳۲]. قطر پایین تخلخل نانولولههای کربنی (بین ۱ تا ۱۰ نانومتر) تنها به آب اجازه عبور میدهد و از گذشتن سایر آلایندههای شیمیایی و زیستی جلوگیری میکند. مهمترین مزیت غشاهای مبتنی بر نانولوله این است که آنها مانند سرامیکها مستحکم و همانند پلیمرها انعطافپذیرند. بعلاوه تراوایی آب از طریق نانولولههای کربنی بسیار زیاد است[۳۳]. در پژوهشی با استفاده از نانولولههای کربنی، غشایی با قطر تخلخل ۱ نانومتر تولیدشده است. در مقایسه با سایر غشاهای تجاری در دسترس، این غشا تا سه برابر قدرت بیشتری در جلوگیری از عبور رنگهای آلی از خود نشان داده است[۳۴]. همچنین غشاهای مبتنی بر نانولولهها توانایی فیلتر کردن باکتریهایی مانند اشرشیا کلای را نیز دارند[۳۵]. به جز قابلیت فیلتر کردن مواد بر اساس اندازه آنها، نانولولهها توانایی بالایی در جذب آلایندههای شیمیایی و زیستی متنوع دارند. در پژوهشی از کامپوزیت نانولوله/ سرامیک برای فیلتراسیون استفاده شد و حذف ۹۸ درصدی قارچ ها و تقریبا ۱۰۰ درصدی یون فلزات سنگین را به دنبال داشت[۳۶]. در شکل ۴ تصویر میکروسکوپ الکترونی روبشی از سلولهای قارچ به دام انداخته شده در زمینه کامپوزیت نانولوله/ سرامیک نشان داده شده است.
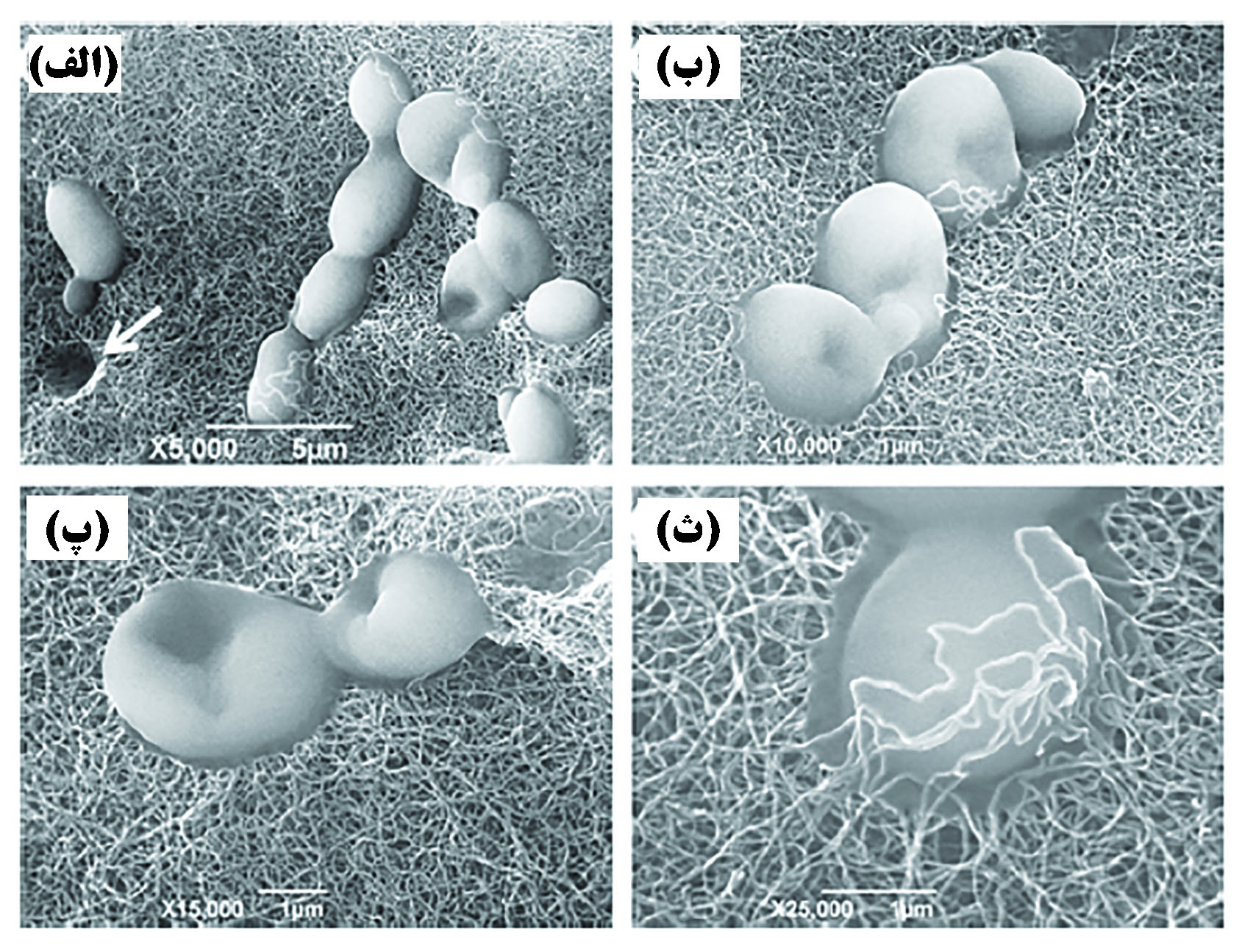
شکل ۴- تصویر میکروسکوپ الکترونی روبشی از فیلتر کامپوزیتی نانولوله / سرامیک[۳۶]
صفحات دوبعدی گرافن با ضخامت تک اتم نیز میتوانند به عنوان غشای نانوفیلتراسیون استفاده شوند. تولید گرافن نسبت به نانولوله ارزانتر است و پایداری شیمیایی و حرارتی مشابه با آن دارد در حالیکه انعطاف بیشتری نسبت به نانولوله از خود نشان میدهد. غشاهای ساخته شده از گرافن قادر به فیلتر کردن رنگهای آلی و سایر نانوذرات است[۳۷]. غشاهای مبتنی بر گرافن میتوانند برای خالصسازی آب نیز مورد استفاده قرار گیرند. با استفاده از غشایی ساخته شد از گرافن با ضخامت ۲۲ تا ۵۳ نانومتر، درصد بالایی از رنگهای آلی موجود در آب فیلتر شدند اما توانایی این غشا در برابر مواد یونی چندان بالانبوده است[۳۸]. در پژوهشی دیگر از اکسید گرافن برای تولید غشا با ضخامت میکرومتری استفاده شده و مشاهده شده این غشا توانایی سد کردن عبور هر نوع مایع، بخار یا گاز به جز آب را دارد[۳۹].
۲-۳- اکسیدهای فلزی
اکسیدهای فلزی دسته دیگری از مواد مقرون به صرفه برای تولید نانوفیلترها هستند. بعلاوه اینکه اکثر آنها در حضور تابش از خود خاصیت فوتوکاتالیستی نشان میدهند که این خاصیت منجر میشود غشاهای تولید شده از آنها بتوانند انواع آلایندههای آلی و معدنی و همچنین میکروبها را از پساب حذف کنند و غشا به جای اینکه صرفا مانعی فیزیکی باشد، نقشی فعال در حذف آلایندهها ایفا کند. در پژوهشی از نانوسیمهای دیاکسید تیتانیوم برای ساخت غشا استفاده شده و حذف اسیدهای هیومیک و مواد آلی در آن مورد بررسی قرار گرفته است. با ترکیب خاصیت فیلتراسیون و فوتوکاتالیستی این نانوذرات، حدود ۱۰۰درصد اسیدهای هیومیک و بیش از ۹۰ درصد مواد آلی موجود تحت تابش فرابنفش حذف شدهاند[۴۰]. همچنین برای افزایش نرخ ممانعت عبور میتوان از کامپوزیت این نانوذرات با نانوذرات آلومینا گاما استفاده کرد. برای افزایش مقاومت به خوردگی غشاهای مبتنی بر نانوذرات تیتانیوم دیاکسید میتوان به آنها نانوذرات زیرکونیوم دیاکسید را اضافه نمود. با افزودن این نانوذرات، غشا قابلیت پایداری در گستره وسیعی از (۱ تا ۱۳) را دارد[۴۱]. در پژوهشی پس از افزودن نانوذرات اکسیدروی به غشای ساخته شده از پلی فنیل سولفون، شار آب عبوری از ۷۶ به ۱۰۷ لیتر بر مترمربع ساعت بار رسید. علت اصلی افزایش شار عبوری، افزایش آبدوستی غشا به دلیل حضور نانوذرات اکسیدروی میباشد. با این وجود افزودن این نانوذرات تغییری در فرایند فیلتراسیون اعمال نکرده است.
۳-۳- زئولیتها
زئولیتها بلورهای آلومینوسیلیکات هستند که در دسته مواد میکرومتخلخل طبقهبندی میشوند و قطر تخلخل آنها از مقیاس کمتر از نانومتر تا نانومتر متغیر است. به دلیل ساختار آلومینوسیلیکاتی زئولیتها، این مواد پایداری حرارتی و شیمیایی بالایی دارند. از این رو این مواد بازده بالایی در کاربردهای اسمز معکوس و نانوفیلتراسیون از خود نشان میدهند. غشاهای نانوفیلتراسیون پلی دیمتیل سیلوکسان که با استفاده از زئولیت پر شدهاند، غشاهای کارامدی هستند که قادر به جداسازی انواع آلایندههای شیمیایی میباشند، پایداری شیمیایی بالایی دارند و تورم شبکه پلیمری غشا را کاهش میدهند. غشاهای حاوی زئولیت همپنین برای جداسازی ترکیبات فلزی و هیدروکربنهای اشباع شده و اشباع نشده استفاده میشوند[۴۲].
۴- جمعبندی و نتیجهگیری
در این مقاله به بررسی روشهای جذب و نانوفیلتراسیون برای تصفیه پساب پرداخته شد. در فرایند جذب، یک ماده به طور فیزیکی یا شیمیایی بر روی ماده دیگری جذب میشود. از روش جذب میتوان برای تصفیه آلایندههای آلی و معدنی استفاده کرد. نانومواد سطح در دسترس بیشتری نسبت به مواد بالک دارند، میتوان آنها را عاملدار کرد و تخلخلهای نانومقیاس دارند که به فرایند جذب کمک میکند. نانوساختارهای کربنی، جاذبهای زیستی، جاذبهای اکسید فلزی، زئولیتها، نانوذرات آهن صفرظرفیتی و هیدروژلها مواد متداول برای استفاده در فرایند جذب هستند. در نانوفیلتراسیون با استفاده از یک غشا که اندازه حفرات آن در ابعاد نانو است، از عبور آلایندهها جلوگیری میشود. در این روش با توجه به بار سطحی غشا میتوان ذرات را به طور انتخابی جداسازی کرد. در ساخت این غشاها از پلیمر یا سرامیکهای معدنی استفاده میشود که هرکدام مزایا و معایبی دارند. از نانوساختارهای کربنی، اکسیدهای فلزی و زئولیتها میتوان برای ساخت غشا استفاده کرد.
۵- منابع
[1] Zhong, L. S., et al. “Self-Assembled 3D Flowerlike Iron Oxide Nanostructures and Their Application in Water Treatment.” Advanced Materials, vol. 18, no. 18, John Wiley & Sons, Ltd, Sept. 2006, pp. 2426–31, doi:10.1002/adma.200600504.
[2] Fairey, Julian L., et al. “Impact of Natural Organic Matter on Monochloramine Reduction by Granular Activated Carbon: The Role of Porosity and Electrostatic Surface Properties.” Environmental Science & Technology, vol. 40, no. 13, American Chemical Society, July 2006, pp. 4268–73, doi:10.1021/es060111j.
[3] Asenjo, Natalia G., et al. “High Performance Activated Carbon for Benzene/Toluene Adsorption from Industrial Wastewater.” Journal of Hazardous Materials, vol. 192, no. 3, 2011, pp. 1525–32, doi:https://doi.org/10.1016/j.jhazmat.2011.06.072.
[4] Al-Omair, M. A., and E. A. El-Sharkawy. "Removal of heavy metals via adsorption on activated carbon synthesized from solid wastes." Environmental technology 28.4 (2007): 443-451.
[5] Hu, Xiaoge, et al. "In situ synthesis and characterization of multiwalled carbon nanotube/Au nanoparticle composite materials." The Journal of Physical Chemistry B 110.2 (2006): 853-857.
[6] Li, Y., et al. “Carbon Nanotubes - The Promising Adsorbent in Wastewater Treatment.” Journal of Physics: Conference Series, vol. 61, Apr. 2007, p. 698, doi:10.1088/1742-6596/61/1/140.
[7] Peng, Xianjia, et al. “Adsorption of 1,2-Dichlorobenzene from Water to Carbon Nanotubes.” Chemical Physics Letters, vol. 376, no. 1, 2003, pp. 154–58, doi:https://doi.org/10.1016/S0009-2614(03)00960-6.
[8] Gorria, Pedro, et al. "Synthesis of magnetically separable adsorbents through the incorporation of protected nickel nanoparticles in an activated carbon." Carbon 44.10 (2006): 1954-1957.
[9] Zhang, Z. L., et al. "Fate and assessment of persistent organic pollutants in water and sediment from Minjiang River Estuary, Southeast China." Chemosphere 52.9 (2003): 1423-1430.
[10] Liu, Xiang Dong, et al. "Preparation and characterization of DNA hydrogel bead as selective adsorbent of dioxins." International journal of biological macromolecules 35.3-4 (2005): 193-199.
[11] Ru, Jia, et al. "Removal of dieldrin from aqueous solution by a novel triolein-embedded composite adsorbent." Journal of hazardous materials 141.1 (2007): 61-69.
[12] Miretzky, P., and A. Fernandez Cirelli. "Hg (II) removal from water by chitosan and chitosan derivatives: a review." Journal of hazardous materials 167.1-3 (2009): 10-23.
[13] Zhang, Shouwei, et al. “Porous Magnetic Carbon Sheets from Biomass as an Adsorbent for the Fast Removal of Organic Pollutants from Aqueous Solution.” Journal of Materials Chemistry A, vol. 2, no. 12, The Royal Society of Chemistry, 2014, pp. 4391–97, doi:10.1039/C3TA14604A.
[14] Iram, Mahmood, et al. “Adsorption and Magnetic Removal of Neutral Red Dye from Aqueous Solution Using Fe3O4 Hollow Nanospheres.” Journal of Hazardous Materials, vol. 181, no. 1, 2010, pp. 1039–50, doi:https://doi.org/10.1016/j.jhazmat.2010.05.119.
[15] Abdolmohammad-Zadeh, Hossein, et al. “Zinc–Aluminum Layered Double Hydroxide as a Nano-Sorbent for Removal of Reactive Yellow 84 Dye from Textile Wastewater Effluents.” Journal of the Iranian Chemical Society, vol. 10, Dec. 2013, doi:10.1007/s13738-013-0255-z.
[16] O’Reilly, S. E., and Michael F. Hochella. “Lead Sorption Efficiencies of Natural and Synthetic Mn and Fe-Oxides.” Geochimica et CosmochimicaActa, vol. 67, no. 23, 2003, pp. 4471–87, doi:https://doi.org/10.1016/S0016-7037(03)00413-7.
[17] Tan, Xiaoli, et al. “Effect of Soil Humic and Fulvic Acids, PH and Ionic Strength on Th(IV) Sorption to TiO2 Nanoparticles.” Applied Radiation and Isotopes, vol. 65, no. 4, 2007, pp. 375–81, doi:https://doi.org/10.1016/j.apradiso.2006.10.014.
[18]Dong, Yi, et al. "Adsorption of bisphenol A from water by surfactant-modified zeolite." Journal of colloid and interface science 348.2 (2010): 585-590.
[19] Bai, Yaohui, et al. "Removal of pyridine and quinoline by bio-zeolite composed of mixed degrading bacteria and modified zeolite." Journal of hazardous materials 181.1-3 (2010): 916-922.
[20] Kesraoui-Ouki, Sabeha, et al. “Effects of Conditioning and Treatment of Chabazite and Clinoptilolite Prior to Lead and Cadmium Removal.” Environmental Science & Technology, vol. 27, no. 6, American Chemical Society, June 1993, pp. 1108–16, doi:10.1021/es00043a009.
[21] Li, Xiao-qin, et al. “Zero-Valent Iron Nanoparticles for Abatement of Environmental Pollutants: Materials and Engineering Aspects.” Critical Reviews in Solid State and Materials Sciences, vol. 31, no. 4, Taylor & Francis, Dec. 2006, pp. 111–22, doi:10.1080/10408430601057611.
[22] Gupta, Anjali, M. Yunus, and NaliniSankararamakrishnan. "Zerovalent iron encapsulated chitosan nanospheres–A novel adsorbent for the removal of total inorganic Arsenic from aqueous systems." Chemosphere 86.2 (2012): 150-155.
[23] Melitas, Nikos, et al. “Kinetics of Soluble Chromium Removal from Contaminated Water by Zerovalent Iron Media: Corrosion Inhibition and Passive Oxide Effects.” Environmental Science & Technology, vol. 35, no. 19, American Chemical Society, Oct. 2001, pp. 3948–53, doi:10.1021/es001923x.
[24] Peng XW, Zhong LX, Ren JL, Sun RC (2012) Highly effective adsorption of heavy metal ions from aqueous solutions by macroporousxylan-rich hemicelluloses-based hydrogel. Journal of Agricultural and Food Chemistry, ACS Publications 60(15): 3909-3916.
[25] Ju XJ, Zhang SB, Zhou MY, Xie R, Yang L, et al. (2009) Novel heavy-metal adsorption material: ion-recognition P (NIPAM-co-BCAm) hydrogels for removal of lead (II) ions. Journal of Hazardous Materials, Elsevier 167: 114-118.
[26] Atta AM, Ismail HS, Mohamed HM, Mohamed ZM (2011) Acrylonitrile/acrylamidoxime/2‐acrylamido‐2‐methylpropane sulfonic acid‐based hydrogels: Synthesis, characterization and their application in the removal of heavy metals. Journal of Applied Polymer Science, Wiley Online Library 122(2): 999-1011.
[27] Ozay O, Ekici S, Aktas N, Sahiner N (2011) P (4-vinyl pyridine) hydrogel use for the removal of UO22+ and Th4+ from aqueous environments. Journal of Environmental Management, Elsevier 92(12): 3121-3129.
[28] Mahida VP, Patel MP (2016) Removal of heavy metal ions from aqueous solution by superabsorbent poly (NIPAAm/DAPB/AA) amphoteric nanohydrogel. Desalination and Water Treatment, Taylor & Francis 57(29): 13733-13746.
[29] J. E. Drewes, C. L. Bellona, and P. Xu, Comparing Nanofiltration and Reverse Osmosis for Treating Recycled Water, IWA Publishing (International Water Assoc), London (2008).
[30] Verliefde, A. R. D., et al. “The Role of Electrostatic Interactions on the Rejection of Organic Solutes in Aqueous Solutions with Nanofiltration.” Journal of Membrane Science, vol. 322, no. 1, 2008, pp. 52–66, doi:https://doi.org/10.1016/j.memsci.2008.05.022.
[31] Van der Bruggen, Bart, Mika Mänttäri, and Marianne Nyström. "Drawbacks of applying nanofiltration and how to avoid them: a review." Separation and purification technology 63.2 (2008): 251-263.
[32] Noy, A, Park, HG, Fornasiero, F, Holt, JK, Grigoropoulos, CP &Bakajin, O 2007, 'Nanofluidics in carbon nanotubes', Nano Today, vol. 2, no. 6, pp. 22-29. https://doi.org/10.1016/S1748-0132(07)70170-6
[33] Falk, Kerstin, et al. “Molecular Origin of Fast Water Transport in Carbon Nanotube Membranes: Superlubricity versus Curvature Dependent Friction.” Nano Letters, vol. 10, no. 10, American Chemical Society, Oct. 2010, pp. 4067–73, doi:10.1021/nl1021046.
[34] Karan, Santanu, et al. “Ultrafast Viscous Permeation of Organic Solvents Through Diamond-Like Carbon Nanosheets.” Science, vol. 335, no. 6067, Jan. 2012, pp. 444 LP – 447, doi:10.1126/science.1212101.
[35] Srivastava, A., et al. "Carbon nanotube filters." Nature materials 3.9 (2004): 610-614.
[36] Parham, Hamed, et al. "A highly efficient and versatile carbon nanotube/ceramic composite filter." Carbon 54 (2013): 215-223.
[37] Qiu, Ling, et al. “Controllable Corrugation of Chemically Converted Graphene Sheets in Water and Potential Application for Nanofiltration.” Chemical Communications, vol. 47, no. 20, The Royal Society of Chemistry, 2011, pp. 5810–12, doi:10.1039/C1CC10720H.
[38] Liu, Zheng, et al. "Wet-spun continuous graphene films." Chemistry of Materials 26.23 (2014): 6786-6795.
[39]Nair, R. R., et al. “Unimpeded Permeation of Water Through Helium-Leak–Tight Graphene-Based Membranes.” Science, vol. 335, no. 6067, Jan. 2012, pp. 442 LP – 444, doi:10.1126/science.1211694.
[40] Zhang, Xiwang, et al. "TiO2 nanowire membrane for concurrent filtration and photocatalytic oxidation of humic acid in water." Journal of Membrane Science 313.1-2 (2008): 44-51.
[41] Gestel, Tim, et al. “ZrO2 and TiO2 Membranes for Nanofiltration and Pervaporation: Part 1. Preparation and Characterization of a Corrosion-Resistant ZrO2 Nanofiltration Membrane with a MWCO<300.” Journal of Membrane Science, vol. 284, Nov. 2006, pp. 128–36, doi:10.1016/j.memsci.2006.07.020.
[42] Gevers, Lieven EM, Ivo FJ Vankelecom, and Pierre A. Jacobs. "Solvent-resistant nanofiltration with filled polydimethylsiloxane (PDMS) membranes." Journal of membrane science 278.1-2 (2006): 199-204.
[43] Wang, Yanqing, et al. "Environmental remediation applications of carbon nanotubes and graphene oxide: Adsorption and catalysis." Nanomaterials 9.3 (2019): 439.
[44] Bora, Tanujjal, and Joydeep Dutta. "Applications of nanotechnology in wastewater treatment—a review." Journal of nanoscience and nanotechnology 14.1 (2014): 613-626.
۶- پاورقی
[1]nanosorbents
[2]sorption
[3]Catalytic combustion
[4] Activated carbon
[5]Triolein
[6]Chitosan
[7]Chelation
[8]Chelating agent
[9]Zeolites
[10]Hexadecyltrimethylammonium(HDTMA)
[11]Pyridine
[12] Quinolone
[13]Chabazite
[14]Clinoptilolite
[15]Nano zero valent iron (nZVI)
[16]Hydrogels
[17]Nanofiltration
[18]Rejecton ability
[19]Rejection rate of the contaminents