چهارشنبه 19 خرداد 1400 کد خبر: 96
.jpg)
۱- مقدمه
روش سل- ژل یکی از روشهای ساده و ارزانی است که با استفاده از آن میتوان نانوذرات مختلف را سنتز نمود. این روش با ساخت یک سل همگن از پیشمادهها شروع میشود و سپس با تحریک شیمیایی سل به ژل تبدیل میشود. بعد از آن با یکی از روشهای معمول، حلال را از ساختار ژل بیرون کشیده و آن را خشک میکنند. بسته به نوع روش خشک کردن، محصول بهدست آمده مورفولوژی و خواص متفاوتی خواهد داشت. محصولات بدست آمده کاربردهای متنوعی در پوششدهی سطوح، عایقکاری ساختمان، ابزارهای اپتیکی و ... دارد. در این بخش روش سل –ژل و عوامل موثر در آن معرفی خواهند شد.
۲- فرایند سل- ژل
فرآیند سل-ژل یک روش سنتز پایین به بالا است. در این فرآیند، محصول حاصل از تعدادی واکنشهای شیمیایی برگشت ناپذیر است. در حقیقت این واکنشها باعث تبدیل مولکولهای محلول همگن اولیه به عنوان سل، به یک مولکول نامحدود، سنگین و سه بعدی پلیمری به عنوان ژل میشوند. بطور نمونه میتوان واکنش هیدرولیزی که در پی آن واکنش تراکم رخ میدهد و محصول نهایی بدست میآید را به صورت زیر خلاصه کرد ( شکل ۱).

شکل ۱- نمای کلی مراحل مختلف واکنش سل- ژل
۳- مراحل فرایند سل- ژل
برای تولید محصول به روش سل- ژل لازم است ابتدا مقدمات و شرایط لازم برای واکنشها را فراهم نمود. مراحل روش سل ژل به طور شماتیک در شکل۲ نمایش داده شده است. این مراحل به ترتیب عبارتند از:
۱- تهیه محلول همگن
۲- تشکیل سل
۳- تشکیل ژل
۴- خشک کردن
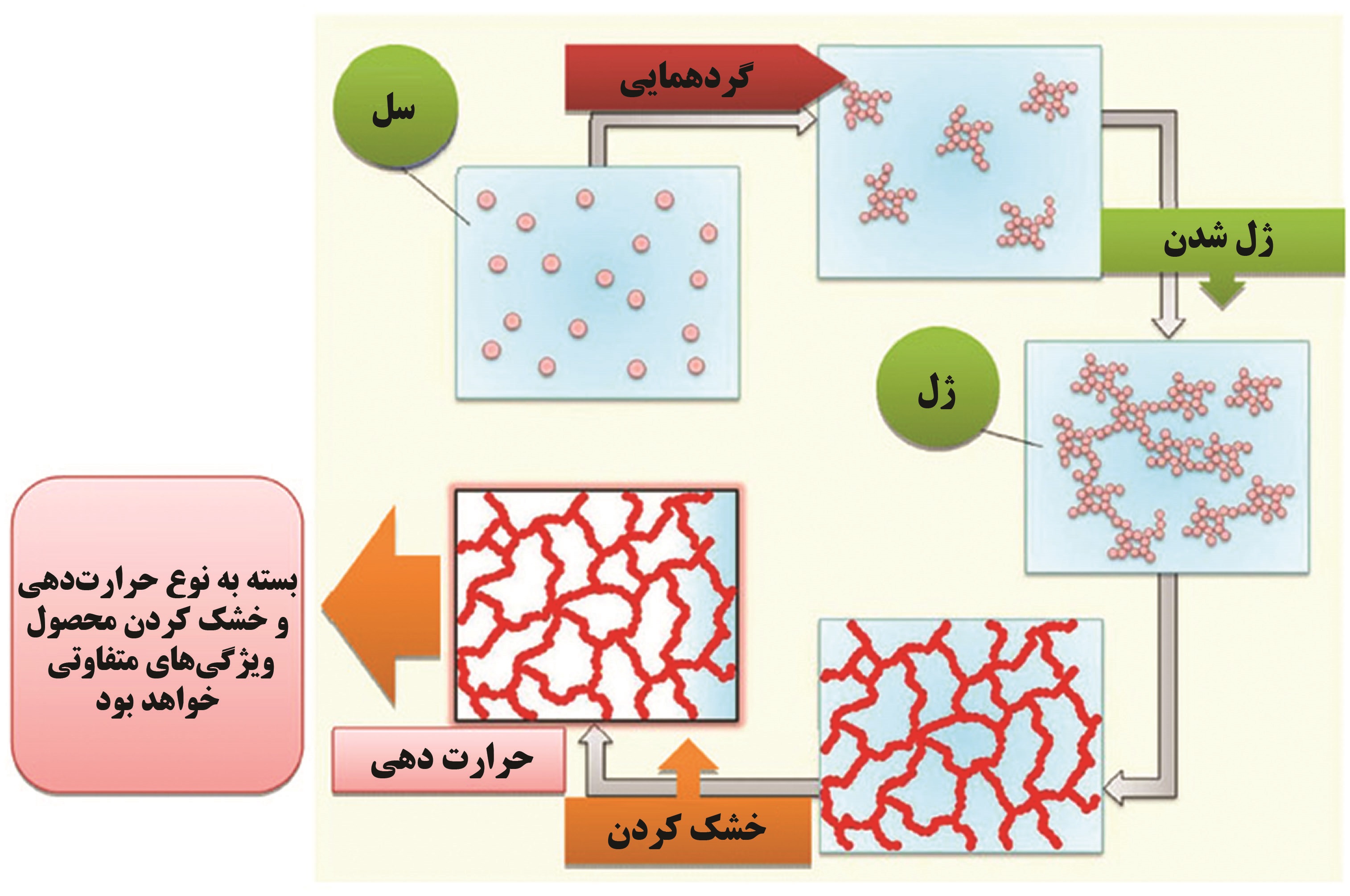
شکل ۲- نمای کلی از تمامی مراحل سل-ژل
۱-۳- تهیه محلول همگن
لازم است تا در ابتدا یک محلول همگن شامل حلال و پیشمادههایی که قرار است در طول فرآیند، محصول نهایی را شکل دهند آماده گردد. برای این کار ابتدا حلال (آب، الکل، حلالهای آلی یا نسبتی از آنها) و پیشماده[۱] را در یک ظرف حل میکنیم تا محلول همگن حاصل شود. گاهی لازم است تا از ترکیب دو حلال با نسبتهای معین استفاده شود تا پیشمادهها به طور کامل در آن حل شود و محلول همگن حاصل شود. به عنوان مثال برخی از پیشمادههای آلی فلزی را ابتدا باید در یک حلال آلی قابل حل در آب حل کرد و سپس محلول حاصل را در آب حل نمود. اما در مواردی که پیشماده مورد نظر نمک فلزی باشد به طور مستقیم در آب قابل حل بوده و نیازی به حلال آلی وجود ندارد.
پیشمادههای آلکوکسیدی بیشتر مورد استفاده قرار میگیرند اما میتوان به طریق دیگری غیر از مسیر آلکوکسیدی نیز روش سل – ژل را پیش برد که به آن مسیر کلوئیدی گفته میشود.
۲-۳- تشکیل سل
پس از ساخت یک محلول همگن باید آن را به سل تبدیل کرد، واکنش هیدرولیز[۲] پایه این مرحله است. اصولا کلمه هیدرولیز از ترکیب دو کلمه هیدرو و لیز تشکیل شده و مفهوم آن تجزیه بوسیله آب است. در شیمی گاهی آب میتواند مولکولی را شکسته و به مولکولهای سادهتری تبدیل کند. به طور خلاصه به دستهای از واکنشها که در آن آب مولکولی را شکسته (بر اثر یک واکنش شیمیایی) و به مولکولهای سادهتر تبدیل میکند اصطلاحا هیدرولیز میگوییم.
واکنش هیدرولیز چندان پیچیده نیست. برای آغاز این فرآیند کمی آب به محیط واکنش افزوده میشود ( این در حالتی است که محلول همگن در حلالی فاقد آب تهیه شده باشد). حضور آب باعث خواهد شد تا واکنش هیدرولیز بر روی پیشماده صورت گیرد و به نوعی آن را فعال کرده تا ذرات اکسید فلزی گرد هم آمده و تشکیل ذرات ریز و جامدی بدهند که در حلال پراکنده هستند. به چنین ترکیبی سل (به عنوان یک محصول میانی فرآیند) اطلاق میشود. در شکل۳ نمای کلی از واکنش هیدرولیز نمایش داده شده است.
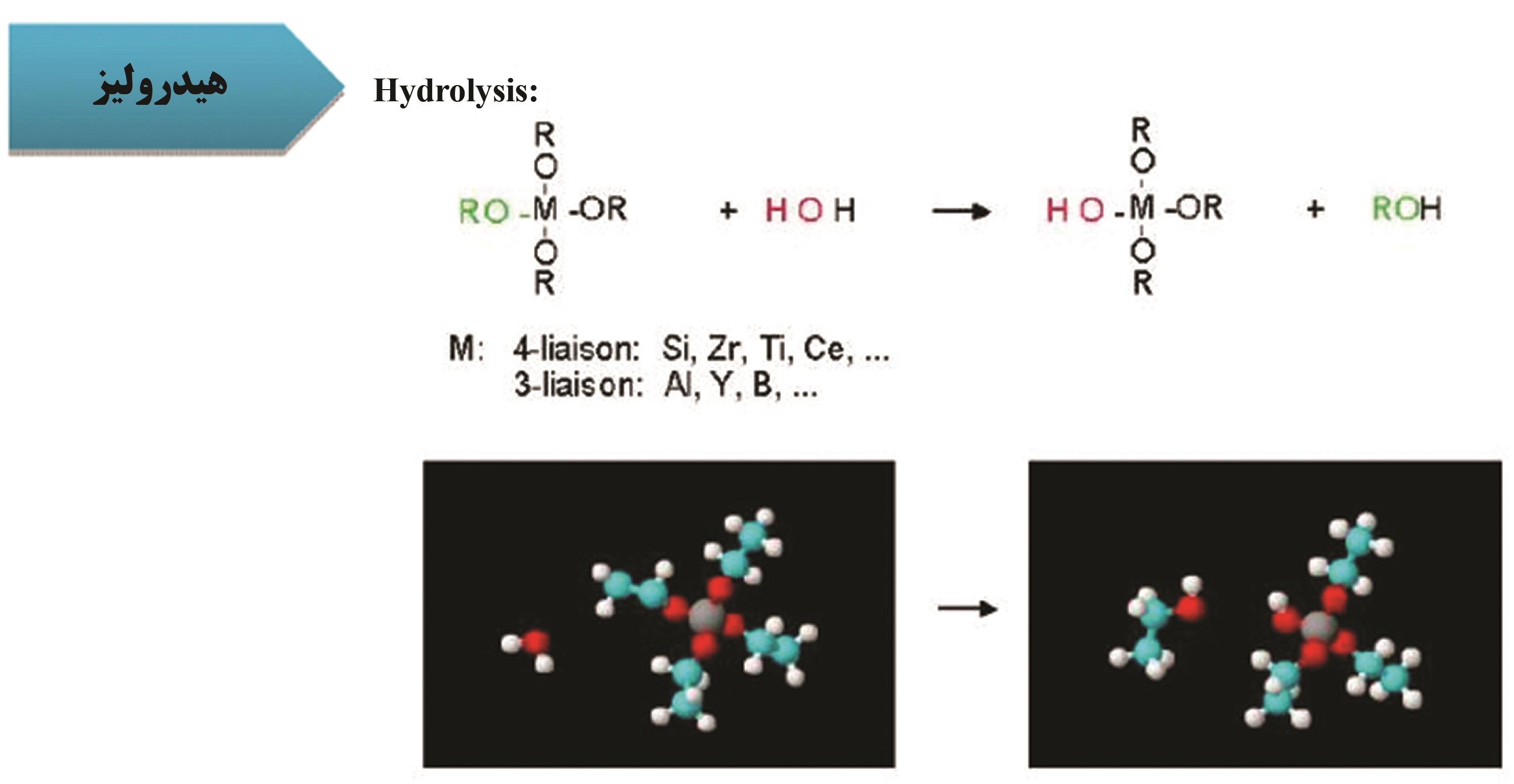
شکل ۳- نمای کلی از واکنش هیدرولیز
سل از کلمه انگلیسی Solution به معنای محلول گرفته شده و لذا محلولی است کلوئیدی از واکنشدهندههای مختلف، (مثل پیشمادهها، حلال، کاتالیزورهای اسیدی یا بازی و سایر افزودنیهای مورد نیاز) که قرار است در ادامه واکنش طی مراحل هیدرولیز و تراکم به ژل تبدیل شود. البته لازم است که به این نکته اشاره گردد که سلها کمی با محلولهای حقیقی متفاوت هستند. در محلول حقیقی جسم حل شونده به صورت اتم، مولکول و یا یون درحلال به طور یکنواخت پراکنده شده و اندازه ذرات از ۱nm تجاوز نمیکند. اما اگر اندازه ذرات بزرگتر از ۱۰۰nm باشد، به تدریج تهنشین میشوند (مخلوط سوسپانسیونی). اگر اندازه ذرات بین ۱ تا حدود ۱۰۰ متغیر باشد، معمولا به صورت پراکنده درهمه جای مخلوط باقی میماند که به این گونه مخلوطها کلویید میگویند. سلها شامل ذرات بسیار ریز (کمتر از ۱۰۰nm) پراکنده شده در فاز حلال هستند و در واقع یک محلول یا به اصطلاح درستتر مخلوط کلوییدی را تشکیل میدهد. پس با توجه به همه توضیحات بالا میتوان سل را اینگونه تعریف کرد که: "سل عبارتست از مخلوط جامد پراکنده شده در مایع که به علت کوچکی ذرات جامد قادر است برای مدت بسیار طولانی (ماهها) پایدار بماند و تهنشین نشود."
مهمترین نکتهای که راجع به یک سل خوب و قابل قبول باید گفت این است که سل حاصل باید به گونهای تهیه شود تا بتواند برای ماهها پایدار باشد و رسوب نکند. به عبارت دیگر باید اندازه ذرات آنقدر کوچک باشد که حرکات براونی ذرات بر نیروی جادبه زمین غلبه کرده و ذرات تهنشین نشوند و برای مدت طولانی همگن باقی بمانند. اگر سل حاصل دارای چنین ویژگی باشد میتوان امیدوار بود تا محصولی همگن، خالص و با بازده بالا تولید شود.
۳-۳- تشکیل ژل
برای این کار کافی است، محلول ساخته شده را به نوعی تحریک کرده، تا ذرات ریز پراکنده شده (که هر کدام شامل چند تا چند ده واحد مولکولی یا اتمی از آغارگرهای مربوطه هستند) شروع به نوعی گردهمایی کنند. با ایجاد بر همکنشهای (فیزیکی و شیمیایی) میان ذرات معلق پراکنده شده در محلول سل، آنها به صورت واحدهایی متشکل از چند ده هزار مولکول کنار هم جمع شده و تشکیل یک مولکول سه بعدی بینهایت بزرگ میدهند که نوعا تمام حجم ظرف واکنش را به خود اختصاص میدهد.
این مولکول غولپیکر که دارای خلل و فرج بسیار فراوانی است تمام حلال را در درون خود به دام میاندازد، و ژل خیس[۳] نام دارد. برای تولید ژل خیس نیاز به تحریک محلول سل داریم تا به ژل برسیم. این تحریک میتواند با استفاده از معرف مناسب (آب خالص یا آب به همراه NaOH ,HCl) انجام شود. در واقع در مرحله تبدیل سل به ژل که توسط واکنشهایی موسوم به تراکم[۴] کنترل میشوند، یک واکنش بسپارش معدنی[۵] به شمار میرود که محصول نهایی آن شبکه اکسیدی حاوی خوشههای اکسید فلزی M-O-M است. در شکل4 نمای کلی از واکنش تراکم نمایش داده شده است.
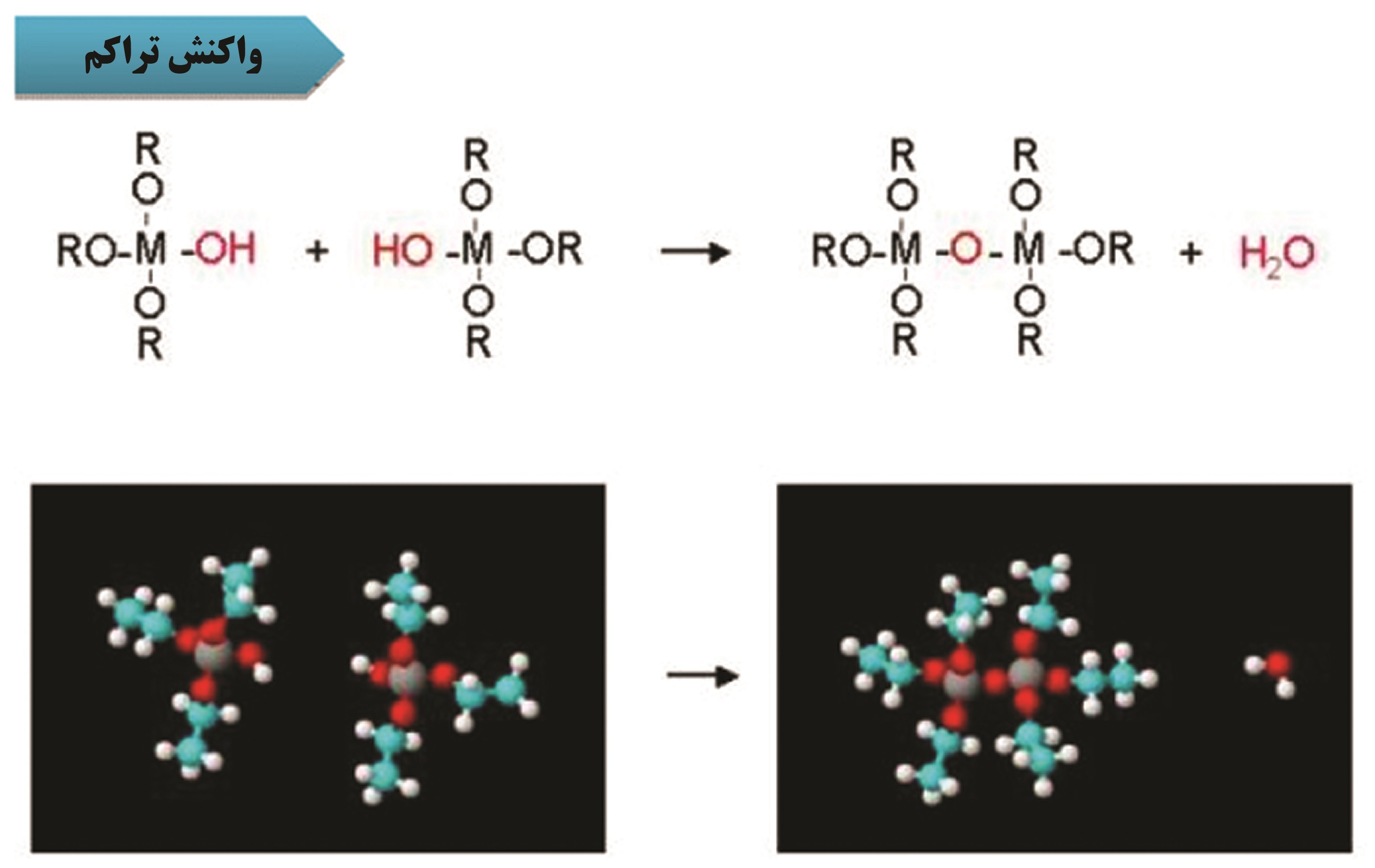
شکل ۴- تصویر مدل سه بعدی مربوط به واکنش تراکم
واکنش تراکم دقیقا عکس واکنش هیدرولیز است. در هیدرولیز مولکولی درشت با مصرف آب به اجزاء سادهتر تبدیل میشود، اما در تراکم دو مولکول ساده به هم میپیوندند و تشکیل یک مولکلول پیچیدهتر را میدهند. در حاشیه این ترکیب شدن یک مولکول کوچک مثل آب آزاد میشود. یک واکنش تراکمی وقتی انجام میشود که دو هیدروکسید (یا یک هیدروکسید + یک آلکوکسید) فلزی (M-OR+HO-M) با هم ترکیب میشوند تا یک اکسید فلزی (M-O-M) ایجاد کنند. ژل در نهایت به عنوان محلول ساخته میشود. در مرحله بعد باید به روشی حلال را از آن جدا کنیم تا فرآیند تکمیل شود. ژلها انواع مختلفی دارند، که هر کدام خصوصیات و کاربردهای مخصوص به خود را دارند. بسته به نوع حلال مورد استفاده یا نوع روش خشک کردن، اسامی، ویژگیها و کاربردهای آنها متفاوت خواهد بود.
با مخلوط کردن نمکهای اولیه متفاوت میتوان سامانههای دوتایی یا سه تایی تولید نمود. هر کدام از نمکهای اولیه دارای سرعت واکنش مربوط به خودش است که این سرعت واکنش، بستگی به شرایطی چون pH، غلظت، حلال و دما دارد. ژل پلیمری ایجاد شده به صورت یک اسکلت سه بعدی شکل میگیرد که این امر باعث بهم پیوستن حفرات شده و پس از خشک شدن با جمع شدن و انقباض، ایجاد یک جامد صلب محکم میکنند. میتوان گفت که مواد نهایی و محصولات را میتوان به صورتی طراحی کرد، که باعث بوجود آمدن تخلخلهای نانو شود که در نتیجه آن، سطح ویژه بسیار بالاتری بدست خواهد آمد.
۴-۳- خشک کردن
از ویژگی ژلها این است که میتوانند شکل ظرفی که در آن تولید شدهاند را به خود بگیرند. بسته به استحکام ساختار ژل، میتوان یک تکه مستقل با حفرههای بزرگ به دست آورد. از آنجا که در این وضعیت حلال یکی از اجزاء داخلی ژل محسوب میشود (شبکه را پابرجا نگه میدارد). حفظ ثبات ساختار حفرهها با برداشتن حلال بسیار دشوار است. معمولاً باید اجازه داد ساختار ژل قبل از خشک کردن، رسیده شود (کمی بماند) تا پیوندهای بین ذرات استوارتر گردد. این مرحله بین چند ساعت تا چند روز طول میکشد. به این فرآیند در اصطلاح پیرسازی[۶] گفته میشود. طی فرآیند پیرسازی، ژل به تغییرات خود ادامه می دهد تا پیوندهای جدید شکل گرفته و استحکام اسکلت ژل بیش از پیش گردد.
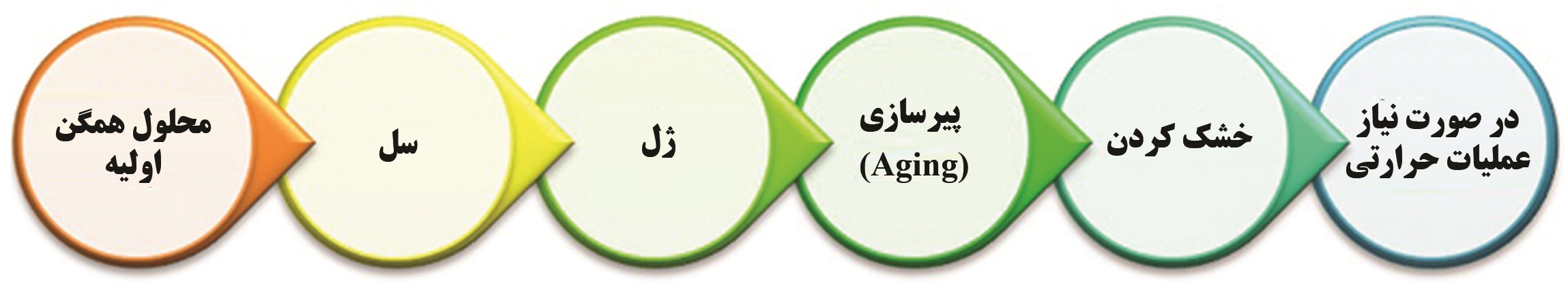
شکل ۵- مراحل مختلف سل ژل و جایگاه فرآیند Aging در آن
در شکل۵ جایگاه مرحله پیرسازی در فرایند سل ژل نشان داده شده است. بعد از فرآیند پیرسازی و تهیه ژل، از راههای مختلف فاز مایع ( حلال) را جدا میکنند. این مرحله جداکردن حلال یا خشک کردن به دو روش کلی انجام میشود:
۱- ماده را در محیط قرار دهیم تا خودبه خود خشک شود. در این حالت، ماده حاصله زیروژل [۷]نام میگیرد و حفرههای کمتری دارد و متراکم است. زیروژل به ژلی گفته میشود که تمام مایع داخل حفرات ژل خارج شده است، به گونهای که ساختار کمی متراکمتر و فشردهتر شده است و چروکیدگی نسبت به وضعیت ژل خیس در آن کاملاً مشهود است (شکل ۶ را ببینید).

شکل ۶- خشک کردن به وسیله تبخیر ساده و تولید زروژل [۵]
۲- راه دیگر روش فوق بحرانی است که در آن تغییرات شبکه جامد به حداقل میرسد. ماده حاصل دارای شبکه متخلخل و پوکی است که آئروژل[۸] نامیده میشود. آئروژل (ژل هوادار) نیز نوعی ژل خشک است. لذا حلال از داخل ژل خارج شده است. در اینجا خروج حلال به گونهای بوده که هیچ فشردگی[۹] یا تغییری در ساختار ژل ایجاد نشده است. این نوع ژل عموماً به این صورت تهیه میشود که ژل را تا دمای بحرانی حلال حرارت میدهند. بنابراین هیچ تعادلی بین مایع و بخار وجود ندارد و ژل با سطح ویژه بالا، با حفظ ساختار، در مقایسه با حالت ژل خیس بدست میآید. بر خلاف زروژل، در آئروژل تمامی خلل و فرج و ساختار حفظ شده و متراکم نمیشود.
خشککردن با یک فرآیند ساده تبخیر و یا با حذف حلال در خلاء امکانپذیر است. در اثر نیروهای مویینگی که از برهمکنش بین حلال و دیوارههای ساختمان ماده در اثر تبخیر حلال ایجاد میشود، انتظار این است که میزان تخلخل کاهش یابد. اگر چنین باشد، بعد از خشک شدن ژل، این تغییر قابل بازگشت نیست. یک راه مقابله با این مشکل حذف سطح تماسی بین فاز گاز و مایع در سامانه است. این موضوع میتواند با برداشتن حلالها در زمانی که در حالت فوق بحرانیشان هستند، حاصل شود. نقطه فوق بحرانی در نمودار فازی جایی است که گاز و مایع به صورت فازهای جدا از هم وجود ندارند. (شکل۷ را ببینید).
بنابراین، حلال بدون نیاز به تغییر فاز حذف میشود. یعنی، نیازی نیست حلال از فاز مایع به گاز تبدیل شده و سپس خارج شود. در این وضعیت حلال در فاز فوق بحرانی است (یعنی جایی که نه مایع است و نه گاز!) در شکل۷ پیکانها و اعداد مسیرهای ممکن را برای رسیدن به این نقطه را نشان میدهد. ابتدا، در یک محفظه کاملاً بسته دما تا بالای نقطه بحرانی (Tc) افزایش مییابد، که فشار را از فشار بحرانی بالاتر میبرد (کمی بالاتر از Pc)، و در نتیجه حالت فوق بحرانی حاصل میشود.
در نمودار فازی فشار- دما، Pc و Tc به ترتیب به فشار و دمای بحرانی اشاره دارند. پیکان های ۱ و ۲ مسیر خشک کردن فوق بحرانی را نشان میدهند. در ابتدا، مایع با افزایش دما به سیال فوق بحرانی تبدیل میشود. فشار هم همزمان افزایش مییابد. در ادامه، با ثابت نگه داشتن دما، فشار پایین آورده میشود. بنابراین سیال فوق بحرانی به فاز گازی تبدیل میشود و از محیط خارج میگردد.

شکل ۷- نمودار فازی فشار- دما برای رسیدن به شرایط بحرانی
در ادامه در عین حال که دما بالاتر از دمای بحرانی است، فشار کم میشود و به این ترتیب سیال فوق بحرانی مستقیماً به فاز بخار میرود و از داخل اتاقک آزاد میشود. چون فشار لازم برای این کار برای حلالهای معمولی بالاتر از 6 مگاپاسکال است، به یک اتوکلاو [۱۰] نیاز است. در حالی که الکل به دماهای بالایی برای رسیدن به حالت بحرانی نیاز دارد، (اتانول حدود ۲34oC) CO2 در دمایی حدود دمای اتاق (حدود ۳۱oC ) بحرانی میشود.
۴- ویژگیهای محصولات روش سل - ژل
دلایل اصلی استفاده از فرآیند سل- ژل، تولید محصولی با خلوص بالا، توزیع اندازه ذرات باریک و دست یافتن به نانو ساختاری یکنواخت در دمای پایین است. اغلب روش سل- ژل جهت سنتز نانو اکسیدهای فلزی مورد استفاده قرار میگیرد.
فرآیند سل- ژل شامل تغییر حالت سل به ژل با استفاده از تکنیکهای مختلف و متفاوت است که در اکثر آنها از خشک نمودن آهسته و ملایم برای حذف حلال استفاده میشود. باید توجه داشت که به دلیل وجود پدیده انقباض در هنگام خشک شدن ژل، باید در طول فرآیند خشک کردن، نکات لازم برای جلوگیری از به وجود آمدن ترک را رعایت نمود. ژل تولید شده قابلیت قالبریزی[۱۱] دارد و با استفاده از آن میتوان قطعات قالبگیری شده را ساخته و با خشک کردن آنها به یک قطعه یکپارچه دست یافت. قطعات که به این ترتیب بدست میآیند میتوانند به عنوان صافی یا غشا مورد استفاده قرار گیرند.
همانطور که در شکل۸ نشان داده شده است، میتوان با انجام فرآیندهای پوششدهی چرخشی[۱۲] و یا غوطهوری فیلمهای نازکی به ضخامت nm۵۰۰-۵۰ را بر روی یک زیرلایه تولید نمود. این فیلمهای نازک تولیدشده کاربردهای وسیعی از لحاظ الکترونیکی، کاربردهای سایشی یا شیمیایی دارند و علاوه بر این بر روی خواص اپتیکی نیز میتواند تأثیرگذار باشند.
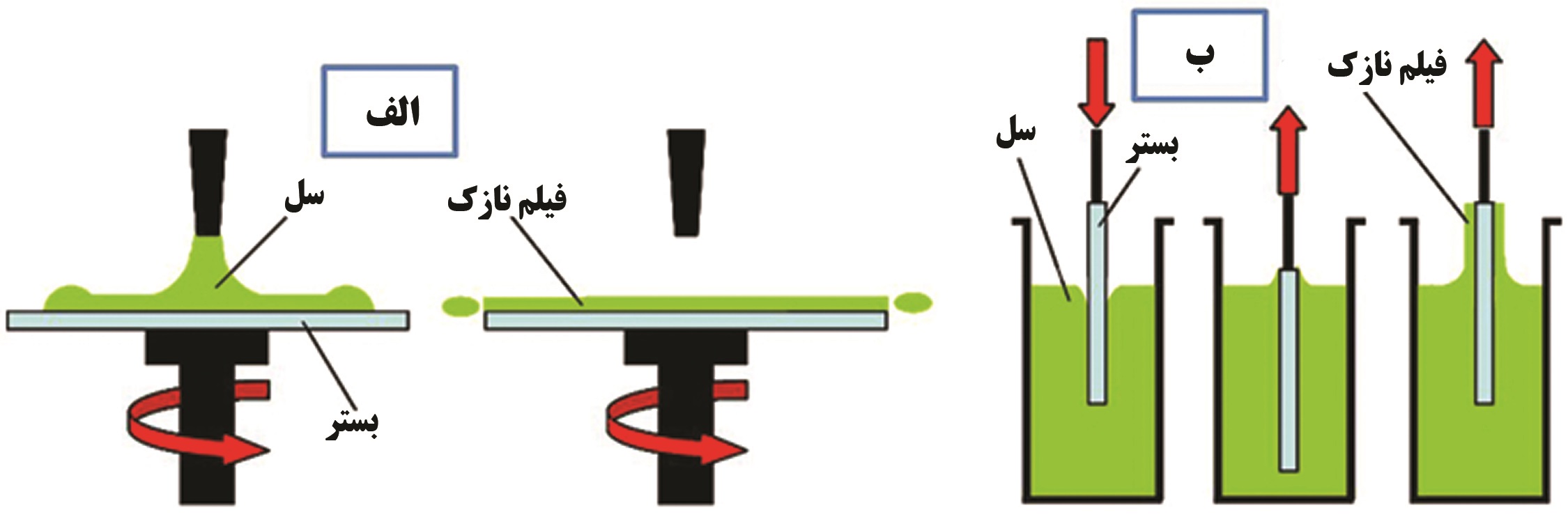
شکل ۸- نمای کلی روش پوشش دهی الف) چرخشی ب) غوطه وری
تخلخلهای پیوسته در مقیاس نانو میتوانند به عنوان محلی جهت پرشدن مواد ثانویه باشند. این عمل با استفاده از روشهایی نظیر تصفیه در فاز مذاب و یا واکنشهای شیمیایی صورت میگیرد. این گونه مواد را در دسته نانوکامپوزیتها طبقهبندی میکنند. یکی از استفادههای مفید از این مواد متخلخل این است که این خلل و فرج را با انواع کاتالیستهای صنعتی پر میکنند و بدلیل سطح فعال بسیار بالای این مواد متخلخل، بهرهوری کاتالیستی بسیار افزایش یافته و موجب کاهش قیمت تمام شده محصول تولیدی میگردد.
برای ایجاد قطعات نسبتا متراکم باید از عملیات حرارتی[۱۳] استفاده نمود. سطح ویژه زیاد، باعث افزایش سرعت فشرده شدن ساختار (تراکم) میشود، ولی باید توجه داشت که افزایش دما جهت انجام فرآیند سینترینگ درعین حال مشکل رشد دانهها را نیز به همراه خواهد داشت. در شکل۹ بطور خلاصه انواع فرآیندهای قابل انجام در سل- ژل و محصولات حاصل از هر فرآیند نمایش داده شده است.
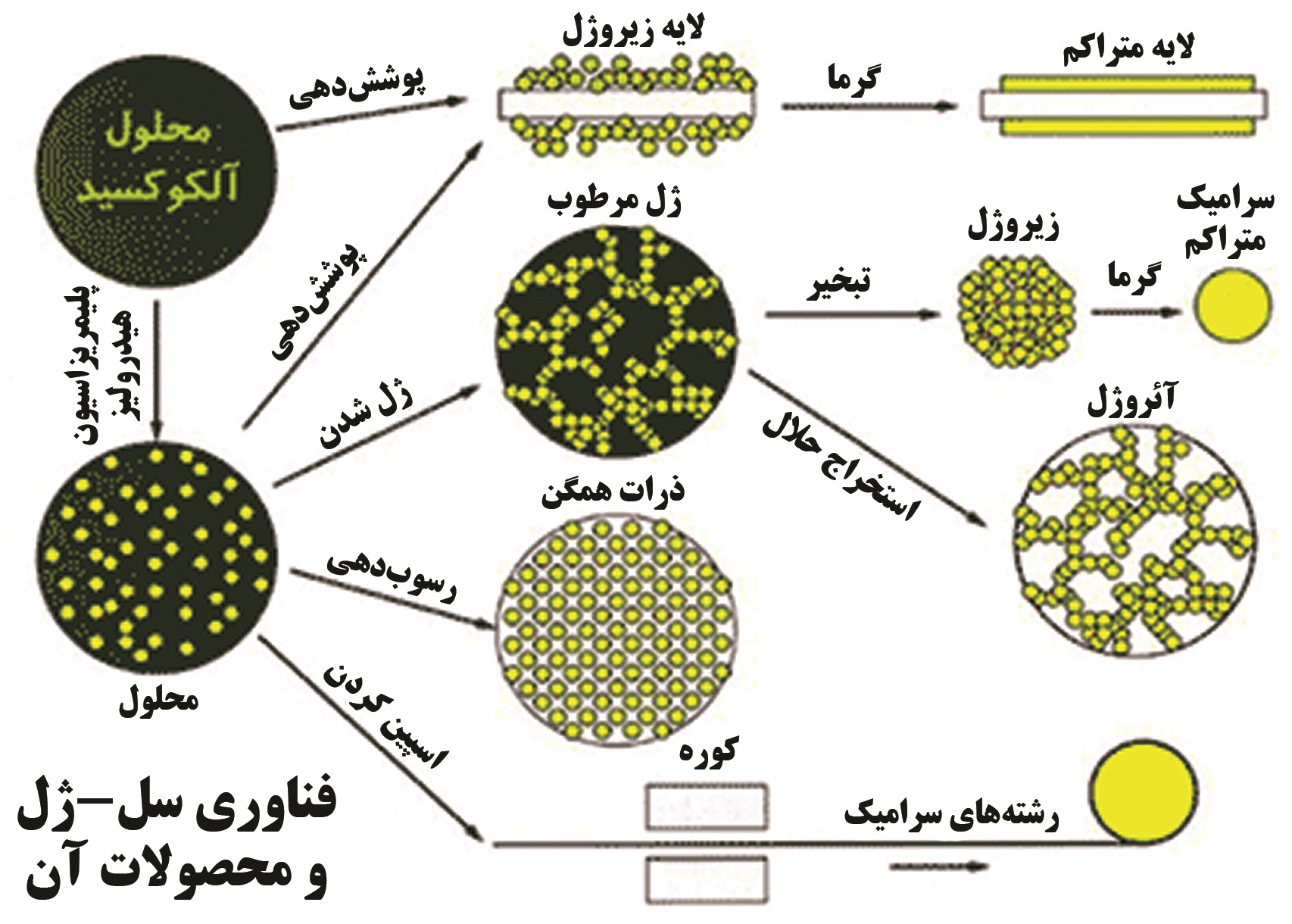
شکل ۹- انواع فرآیندهای قابل انجام در سل- ژل و محصولات حاصل از هر فرآیند
۵- جمعبندی و نتیجهگیری
سل- ژل یکی از مهمترین روشها برای تهیه نانوذرات اکسید فلزی است. در این مقاله به بررسی مراحل مختلف فرآیند سل-ژل در سنتز نانوذرات پرداختیم. این مراحل شامل تهیه سل مناسب از مواد اولیه، تبدیل سل به ژل، پیرسازی، خشک کردن معمولی و خشک کردن در اتوکلاو و در نهایت کلسیناسیون میشد. نانوذرات بدست آمده از فرآیند سل- ژل دارای خلوص بالا و توزیع اندازه باریکی از نظر اندازه ذرات هستند. سل- ژل روش یکی از روشهای مهم برای تولید مواد نانومتخلخل نظیر آئروژل است.
۶- مرجع
[1]. http://edu.nano.ir/
۷- پاورقی
[1]Precursor
[2] Hydrolysis
[3] Wet Gel
[4] Condensation
[5] Inorganic Polymerization
[6] Aging
[7] Xerogel
[8] Aerogel
[9] Contraction
[10] Autoclave
[11] Casting
[12] Spin Coating
[13] Sintering