یکشنبه 11 آبان 1399 کد خبر: 47

۱-مقدمه
بنا به تعريف عمومي، نانوذرات به ذراتي اطلاق ميشود كه از لحاظ اندازه بين يك نانومتر تا ۱۰۰ نانومتر و يا از لحاظ تعداد اتمها بين ۱۰ تا ۱۰۶ اتم باشند. وقتي ابعاد يك ماده توده يا حجيم شروع به كوچك شدن ميكند در ابتدا تغيير خاصي در خواص آن به چشم نميخورد. اگر اين روند همچنان ادامه يابد و مدام ابعاد كوچك و كوچكتر شود در مقياس ميكرومتر تغييرات نسبي در برخي خواص ماده مشاهده ميشود كه باز در صورت كوچكتر كردن ابعاد و رسيدن به مقياس نانو اين تغييرات بسيار شگفتانگيز شده و ويژگيهای بهدست آمده بسيار منحصر به فرد هستند.
بنابراين مواد در گذار از مقياس بالك(توده يا حجيم) به مقياس نانو در خواص مختلف خود از قبيل خواص فيزيكي، مكانيكي، شيميايي، مغناطيسي و ... دستخوش تغييراتي ميشوند كه اين تغيير در بعضي از حوزهها مانند حوزه مغناطيسي، عمده و پيچيدهتر مي باشد.
يكي از پارامترهايي كه در حوزه خواص حرارتي جالب توجه بوده و در اثر كوچك شدن ابعاد در مقياس نانو دچار تغيير ميشوند نقطه ذوب ماده ميباشد. بهطور كلي از دلايل مهم در تغيير خواص از مقياس حجیم (Bulk) به مقياس نانو ميتواند به دو مورد مهم اشاره كرد:
۱- اثرات سطحي: افزايش نسبت سطح به حجم و در نتيجه افزايش تعداد اتمهاي سطح به اتمهاي حجم ماده.
۲-اثرات كوانتومي: تبديل نوارهاي انرژي به ترازهاي انرژي و تغيير اندازه گاف انرژي [۱].
ازآنجا كه در بحث مورد نظر در ارتباط با تغييرات در دماي نقطه ذوب مورد اول ذکر شده يعني اثرات سطحي نقش بسيار مهمي را دارا ميباشد، براي بررسي كمي اين اثر، مثال ميزان افزايش سطح به حجم يك ذره مكعبي 8cm3اي در تبديل به تعدادي نانو ذره مكعبي به ضلع ۱۰nm را مورد بررسي قرار ميدهيم.
يعني تعداد ذرات مكعبي ساخته شده تا میباشد.
و مجموع سطوح جانبي مكعبهاي ثانويه برابر است با:
بنابراين با تبديل صورت گرفته، نتيجه دو ميليون برابر ميشود.
همچنین ميزان افزايش نسبت سطح به حجم بر اثر تقسیم یک ذره به صورت نمادین نیز در شکل (۱) نشان داده شده است.
شکل (۱) : تصویری نمادین از افزایش نسبت سطح به حجم در تقسیم یک ذره.
۲- نقطه ذوب
همانطور كه در مقدمه بحث اشاره شد هر چه اندازه نانوذرات كاهش يابد نسبت سطح موثر به حجم ذرات افزايش مييابد. بنابراين در دنياي ماكرومقياس، مواد با توجه به خواصشان دستهبندي شده و سپس متناسب با اين خواص براي استفادههاي مختلف انتخاب ميشوند. به عنوان مثال، طلا در مقياس حجيم واكنشپذيري ياپيني داشته و اكسيد نميشود، مس براي انتقال برق مناسب بوده و يا شيشه شفاف است و نور را از خود عبور ميدهد. اما در مقياس نانو ديگر نميتوان بدون در نظر گرفتن اندازه ذرات يك ماده آنها را از روي خواصشان شناسايي كرد.
به عنوان مثال، اگر شمشهاي بزرگ طلا را به قسمتهاي چند ميليمتري تقسيم كنيم نقطه ذوبشان تغيير نميكند و همچنان به رنگ زرد ديده ميشود. اما نقطه ذوب ذرات ۵۰ نانومتری طلا با نقطه ذوب ذرات ۱۰ نانومتری طلا متفاوت بوده و نيز داراي رنگهاي متفاوت ميباشند. در نتيجه در مورد وابسته بودن خواص ماده به اندازه ذرات آن ميتوان به طلا اشاره كرد كه طلا در مقياس حجیم داراي نقطه ذوب بالا و واكنشپذيري پايين بوده اما نانو ذرات طلا داراي نقطه ذوب پايين و واكنشپذيري بالا ميباشند [۲]. شكل(۲) روند كاهش نقطه ذوب ذرات طلا را برحسب كاهش اندازه ذرات ماده نشان ميدهد.
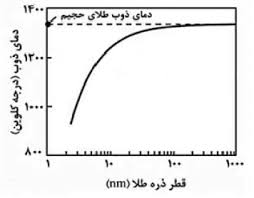
شکل (۲): وابستگی دمای نقطه ذوب طلا به اندازه ذره.
مشاهده ميشود كه نرخ كاهش نقطه ذوب در اندازه ذرات خيلي كوچك بسيار شديد است. براي اين كه بتوانيم در مورد نقطه ذوب يك جسم جامد صحبت كنيم، بهتر است تعريف يكسان و مرجعي براي نقطه ذوب ساده داشته باشيم. بدين منظور شرط يا معيار ذوب شدن ماده را تعريف ميكنيم.
معيار لیندمان: بر اساس معياري كه لیندمان در سال ۱۹۱۰ ارائه داد، هنگامي كه ميانگين دامنه نوسانهاي اتمي ماده به ضريب مشخصي از مقدار ثابت شبكه برسد، اين ارتعاشات ديگر نميتوانند بدون آسيب رساندن و تخريب شبكه افزايش يابند. بنابراين با افزايش ميانگين دامنه ارتعاشات به مقادير بيشتر، ماده از حالت بلوري خارج شده و ذوب ميشود. بنابراين به لحاظ مفهومي كاهش در دماي نقطه ذوب ناشي از افزايش تعداد اتمهاي سطحي است كه با سه ديدگاه زير قابل توجيه است:
۱- اتمهاي سطحي نسبت به اتمهاي مشابه در حجم ماده پيوندهاي كمتري تشكيل ميدهند زيرا اتمهاي درون حجم نسبت به اتمهاي سطحي تعداد بيشتري اتم در همسايگي با خود دارند، در نتيجه براي اتمهاي سطحي غلبه بر اين پيوندها و گسستن آنها به انرژي كمتري نياز دارد و اين خود باعث تسهيل در فرآیند ذوب ميشود.
۲- تمام اتمهاي موجود در ماده در هر دمايي مقدار مشخصي از انرژي كل را به دلـيل نوسانهاي مـوجود به خود اخـتصــاص میدهند. ميزان دامنه اين نوسان در تمام اتمهاي ماده يكسان نيست، بلكه اتمهاي سطحي به دليل آزادي فضايي بيشتري كه در اختيار دارند دامنه نوسان بيشتري دارند، بنابراين با كوچك شدن ابعاد ماده تا حدي كه نسبت تعداد اتمهاي سطح به تعداد اتمهاي حجم به مقدار چشمگيري برسد، ميانگين دامنه نوسانهاي اتمي افزايش قابل ملاحظهاي خواهد يافت و شرط معيارليندمان زودتر و يعني دردماي پايينتر برآورده خواهد شد.
۳- از نگاهي ديگر، ميتوان گفت كه با آمدن از حجم به طرف سطح، معمولا فاصله شبكهاي كمتر شده و اين نيز دليلی بر تامين شدن معيار ليندمان در دماهاي پایینتر است. از مزاياي فني نهفته در دماي ذوب پايين ذرات كوچك ميتوان به دو مورد زير اشاره كرد :
در بررسي تاثير اندازه و نيز شكل ذرات در دماي نقطه ذوب تئوري واحدي وجود نداشته و صرفا مدلهاي متفاوتي در اين زمينه وجود دارد كه دو مدل از آنها را در ادامه مورد بحث و بررسي قرار ميدهيم.
الف) مدل ذوب همگن (Hemogenous Melting Model)
در اين مدل فرض ميشود كه يك اتم جامد با حالت مايعاش در حالت تعادل است و در يك دماي خاص اتم جامد به مايع تبديل ميشود. يعني در يك دما همه اتمها ذوب ميشوند و به همين دليل مدل همگن ناميده ميشود.
در اين مدل:
| (۱) |
در معادله فوق:
، دماي ذوب نانو ذرات
، دماي ذوب ماده در حالت حجیم
d، قطر ذره
، گرمای نهان ذوب ماده حجیم
، چگالی فاز جامد
، چگالی فاز مایع
، انرژي فصل مشترک جامد- بخار(Solid- Vapor- Interface Energy)
، انرژي فصل مشترك مايع- بخار (Liquid Vapor Intreface Enevgy) است.
در معادله (۱) مشاهده مي شود كه Tmn<Tmb و :
۱) هر چه d، تفاوت Tmn و Tmb بيشتري ميشود يعني نرخ كاهش نقطه ذوب در اندازه خيلي كوچك شديدتر است.
۲) اگر d، در اين صورت Tmn=Tmb ميشود كه اين مورد نیز قابل انتظار است.
۳) به دلیل وجود و که به سطح مشترک بستگی دارند و با نانو شدن ذرات این سطح افزایش می یابد Tmn کاهش مییابد.
۴) اگر:
| (۲) |
به اين نكته بايد توجه نمود كه، فصل مشتركها، مكانهاي بسيار مهمي در علم متالورژي هستند. اتمهايي كه در فصل مشترک يا نزديك فصل مشترك قرار دارند نسبت به اتمهاي عمق انرژي بالاتري دارند و منشا انرژي سطح آزاد اين است كه اتمهاي سطح، نزديكترين همسايههاي خود را از دست دادهاند.
ب) مدل مبتني بر انرژي همدوسي (مدل وابسته به اندازه و شكل ذرات):
مدلهايي كه سعي در توضيح بستگي دماي ذوب به اندازه ذرات داشتهاند (مانند مدل الف) يك مشخصه عمومي آنها در نظر گرفتن نانوذرات به شكل كروي ايده آل است. از آنجا كه افت دماي ذوب در نتيجه بزرگتر شدن نسبت سطح به حجم است و افزايش سطح نانوذرات در شكلهاي مختلف نيز با يكديگر متفاوت است، بنابراين بررسي دقيقتر مستلزم در نظر گرفتن شكل ذرات نيز مي باشد. براي بررسي اين مدل ابتدا انرژي همدوسي را تعريف ميكنيم:
انرژي همدوسي (Cohesive or Binding Energy):
انرژي همدوسي يا انرژي چسبندگي يك ماده(مايع يا گاز)، مقدار انرژي است كه به ساختار ماده داده ميشود تا به اتمهاي تشكيلدهنده آن تفكيك شود[۴و۳]. در واقع انرژي همدوسي، انرژي لازم براي شكستن تمام پيوندهاي ايجاد شده با هر يك از اجزا است. جهت شروع بررسي مدل فوق براي لحاظ كردن فاكتور شكل () از رابطه زیر استفاده ميشود [۵]:
( بودن بعد است)
در رابطه فوق:
مساحت سطح نانوذرات كروي:
مساحت سطح نانو ذرات با هر شكلي كه حجم آن با حجم نانو ذره كروي يكسان است:
اگر اتمهاي نانوذرات، كروي ايدهآل در نظر گرفته شوند، توزيع سطح هر اتم خواهد بود(r،شعاع اتمي است).
| :تعداد اتمها در سطح ذره | |
| :تعداد كل اتمها در ذره | |
| :تعداد اتمهاي داخلي |
پيوندهاي هر اتم مجموع برهمكنشهاي بين آن اتم و ديگر اتمهاست كه معمولا برهمكنش با نزديكترين اتمها در نظر گرفته ميشود. اگر تعداد پيوند هر اتم داخلي با اتمهاي اطرافش را در نظر بگيريم با توجه به اينكه فاصله بين اتمهاي سطحي و نزديكترين اتمهاي داخلي بزرگتر از فاصله بين اتمهاي داخلي است بنابراين كمتر از نصف حجم هر اتم سطحي در شبكه حضور دارد كه اين بدين معناست كه بيشتر از نصف پيوندهاي اتمهاي سطحي آويزان هستند (dangling bond). بنابراين میتوان به تقريب تعداد پيوندهاي يك اتم سطحي را در نظر گرفت.
با توجه به اين كه انرژي همدوسي، مجموع انرژي پيوندي تمام اتمهاست:
| ( | (۳) |
با كمي محاسبه ميتوان نشان داد:
برای حالت حجیم:
| (۴) |
در معادله (۴) فاكتور شکل () و نيز فاكتور اندازه ذره (D) آمده است. انرژي همدوسي و دماي ذوب پارامترهايي هستند كه ميتوانند قدرت پيوند را توصيف كنند. با تركيب رابطه تجربي دماي ذوب و انرژي همدوسي ميتوان نوشت.
| (۵) |
در معادله (۵):
، دماي ذوب وابسته به اندازه و شكل ذره
، دماي ذوب حجیم
r، شعاع اتم
D، قطره ذره
، فاكتور شكل ذره است.
معادله(۵) يك معادله كلي براي وابستگي اندازه و شكل در دماي ذوب كريستال است. بنابراين با معادله فوق ميتوان در مورد تغييرات دماي نقطه ذوب با فاكتور شكل در يك اندازه معين و بالعكس بحث نمود. همچنين از معادله فوق نتيجه ميشود كه در عناصر با ساختار كريستالي يكسان، با افزايش شعاع اتمي (r)، وابستگي نقطه ذوب به اندازه ذرات شديدتر ميشود. مقادير محاسبه شده فاكتور شكل براي چند ذره با شكلهاي مختلف به صورت زير است:
در مقایسه معادلههای به دست آمده از مدلهایی مورد بحث میتوان گفت که در تمام مدلها معادله کلی زیر برقرار است که معادله گیبس- تامسون نامیده میشود.
| (۶) |
در معادله فوق:
T، دمای ذوب وابسته به اندازه و شکل ذرات
، دمای ذوب در حالت حجیم
d، قطر ذره
c، تابع تعدادی پارامتر ساختاری است.
۳- جمعبندی و نتیجهگیری:
به طور کلی میتوان گفت با کوچکتر شدن ابعاد ماده و رسیدن به محدوده نانو، تغییراتی در خواص وابسته به جسم از جمله در کمیت ماکروسکوپیک دمای نقطه ذوب ایجاد میشود. در بررسی چگونگی تغییر دمای نقطه ذوب با تغییر در اندازه و شکل ذره، مدلهای متفاوتی ارائه شدهاند که همگی این مدلها نهایتا به معادله گیبس–تامسون منجر میشوند. این معادله کاهش نقطه ذوب بر اثر کاهش اندازه ذره را نشان میدهد که همین تغییر در نقطه ذوب منشا بسیاری از کاربردها در زمینههای مختلف میباشد. در عمل دسترسی به نانوذرات با اندازهها و شکلهای متفاوت توسط مهندسی سنتز آنها با روشها، پیشمادههای مختلف و شرایط مختلف سنتز ( از لحاظ دما و زمان واکنش و ...)صورت میپذیرد.
۴- مراجع :
[2] دنیای نانو،شماره هجدهم، سال ششم، (1389)،ص 18-13س. داوری، دکتر کا نجاتی
[3] Ashcroft N, Mermin N. Solid State Physics (Saunders College, Philadelphia)1976.
[4] C. Kittel, “Solid State Physics,” 5th ed. (John Wiley & Sons, New York, 1976).
[5] Qi W, Wang M. Size and shape dependent melting temperature of metallic nanoparticles. Materials chemistry and physics. 2004;88(2-3):280-4.