چهارشنبه 13 مرداد 1400 کد خبر: 109
۱- روشهای سنتز شیمیایی
در بسیاری از سنتزهای نانو، هدف تهیه نانوذرات تکپخش[۱] است. همچنین یک روند سنتز زمانی ارزشمند است که تغییرات در اندازه ذرات محصول کمتر از ۵% باشد. نانوذراتی که گستره اندازه محدود دارند، خصوصیات همگن و ویژهای را از خود نشان میدهند. تنها چنین نانوساختارهایی این قابلیت را دارند که به طور گسترده در محصولات صنعتی به کار روند. از این رو ارائه روشهای سنتز نانومواد در مقیاس بالا که منجر به تولید ذرات تکپخش و همگن میشوند بسیار قابل توجه است. به طور کلی سنتزهای شیمیایی روشهایی را در بر میگیرند که شامل رسوبگیری از فاز مایع (یا محلول) است. این روشها در مقابل روشهای مکانیکی سنتز نانومواد (معمولا رویکردهای بالا به پایین) و روشهای فیزیکی (معمولا روشهای سنتز از فاز گازی) قرار میگیرند. در برخی متون این روشها با نام روشهای سنتز تر یا مرطوب[۲] و یا سنتز از فاز محلول[۳] نامگذاری میشوند. میتوان گفت که در این حالت گونههای محلول به فرم شیمیایی نامحلول (یا کممحلول) تبدیل میشوند. روشهای شیمیایی سنتز نانومواد، از آن جهت که از رویکردهای پایین به بالا محسوب میشوند، توانایی مهندسی نانوساختار و همچنین اصلاح سطح را فراهم میآورند. همچنین روشهای سنتز از فاز محلول همانند روشهای فیزیکی (و برخلاف بسیاری از روشهای مکانیکی)، علاوه بر نانوپودرها قابلیت ساخت لایهنازک با فناورینانو را نیز دارا میباشند. این در حالی است که روشهای شیمیایی در مقایسه با روشهای فیزیکی اساسا به امکانات سادهتر و ارزانتری نیازمندند که این خود یک مزیت عمده در مقیاس تحقیقات آزمایشگاهی و همچنین تولیدات صنعتی محسوب میشود.
روشهای تخریب حرارتی،[۴] سولوترمال و هیدروترمال[۵]، سنتز در میکروامولسیون یا مایسل معکوس، سل-ژل و روشهای ترسیب شیمیایی از این دستهاند.
۲-روش ترسیب شیمیایی[۶]
میتوان گفت که روش ترسیب شیمیایی، اصلیترین و جزء اولینها در میان روشهای شیمیایی ساخت نانوذرات است. این روش گاه به طور دقیقتر روش همرسوبی[۷] نیز نامیده میشود، چرا که همرسوبی فرآیندی است که در آن یکماده محلول در محیط به یک ساختار نامحلول تبدیل میشود. اصول این روش سنتزی در بسیاری از روشهای دیگر سنتز از فاز محلول نیز تکرار میشود. به طور عمومی، تشکیل محصولات کممحلول از فاز آبی اساس این روش است. فرآیند رسوبگیری شیمیایی مراحل هستهزایی و رشد را در بر دارد. کنترل همین دو مرحله است که منجر به تولید محصولات با کیفیت میگردد. بسیاری از ترکیباتی که با این روش (خصوصا در دماهای پایین ایجاد میشوند)، حالت بیشکل (آمورف) دارند. لذا برای بهدست آوردن محصولاتی با ساختار بلوری مناسب، انجام فرآیندهای حرارتی ثانویه همچون کلسینه شدن یا بازپخت ضروری است. هرچند چنین فرآیندهای حرارتی ثانویهای میتوانند منجر به کلوخهای شدن و کاهش کیفیت ذرات محصول شوند. از همین رو تهیه ذرات تکپخش با روش ترسیب شیمیایی به سختی مهیا میشود.
۳- واکنشهای شیمیایی در سنتزهای نانو
اساس روشهای شیمیایی تر جهت سنتز نانوذرات، بسیاری از واکنشهای شیمیایی پایهای است. همانگونه که ذکر شد، بسیاری از این واکنشها در نهایت منجر به رسوب دادن ذرات جامد از فاز محلول میشوند. گاه این واکنشها به صورت کلی فرآیندهای سنتزی همرسوبی نامیده میشود. اینها مواردی همچون واکنشهای رسوبی[۸]، اکسایش-کاهش[۹] و فرآیندهایی همچون آبکافت[۱۰]، گرماکافت[۱۱]، بسپارش[۱۲] و تراکم[۱۳] را شامل میشود. در زیر هریک از این واکنشها بهصورت مختصر آورده شده است.
۱-۳- واکنشهای رسوبی
زمانی که غلظت ترکیب از حلالیت آن فراتر میرود، ماده شروع به رسوب کردن میکند. گاه رسوبگیری در شرایط فوق اشباع صورت میگیرد. معمولا واکنشهای جانشینی متقابل میتوانند منجر به تولید جامد یونی کممحلول شوند که محصول رسوبی را ایجاد میکند. گاه این واکنش بهطور ساده واکنش جانشینی دوگانه خوانده میشود. در زیر شمای کلی واکنش جانشینی دوگانه و واکنش بین نمک نیترات نقره و سدیم کلرید به عنوان یک مثال آورده شدهاست:
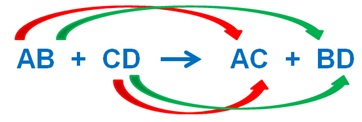 |
در اینجا کلرید نقره کم محلول است و تقریبا به محض تولید در محلول، رسوب میکند (که با حرف (S) در معادله نمایانده شده است). محصول سدیم نیترات که با (aq) در معادله نمایانده شده، در محیط آبی محلول است و به صورت یونهای مجزای +Na و -NO3 وجود دارد. در اصل میتوان گفت که این یونها تنها نقش همراه[۱۴] یا ناظر[۱۵] را داشتهاند و خود در واکنش شرکت نکردهاند. با حذف یونهای ناظر میتوان واکنش کلی را بهصورت زیر نوشت:
در اینجا یونهای نقره و کلرید (بر خلاف کاتیون سدیم و نیترات) تنها در غلظت بسیار پایین میتوانند در کنار یکدیگر در محلول آبی حضور داشته باشند و سریعا تشکیل رسوب میدهند. از طرف دیگر در جهت عکس معادله بالا میتوان گفت که رسوب کلرید نقره بهمیزان کم در محیط آبی محلول است و یونهای نقره و کلرید آزاد کمی بر اثر انحلال ناچیز آن در محیط ایجاد میگردد. یک واکنش جانشینی ترسیبی ساده با در نظر گرفتن ضرایب استوکیومتری میتواند به صورت زیر بیان شود:
رابطه تعادل ترمودینامیکی بین محصول و اجزای تشکیلدهندهی واکنش بالا بر حسب غلظت (بهجای فعالیت) با عبارت حاصلضرب حلالیت بیان میگردد:
عبارات درون براکت نشان دهنده غلظت گونههای A و B میباشند. مقادیر Ksp و درنتیجه حلالیت برای برخی ترکیبات از جمله هیدروکسیدها، کربناتها، اگزالاتها[۱۶] و کلکوژنایدها[۱۷] در حلال آبی کوچک میباشد. مقادیر حاصلضرب حلالیت در جداول مربوطه در کتابهای شیمی تجزیه آورده شدهاست.
۲-۳- واکنشهای اکسایش-کاهش
همانگونه که در بالا ذکر شد، هرچند واکنشهای جانشینی دوگانه میتوانند منجر به تشکیل ترکیبات کممحلول شوند، اما واکنشهای دیگری نیز ترکیبات کممحلول را فراهم میآورند. واکنشهای اکسایش-کاهش با تغییر در عدد اکسایش اجزاء بهکار رفته در واکنش همراه هستند (برای مرور بر مفهوم اعداد اکسایش میتوانید به کتب شیمی عمومی مراجعه نمایید). برای تهیه فرم نامحلول از یون فلزی در محیط آبی به طور معمول از واکنش کاهش استفاده میشود. نیمواکنش احیای فلز در زیر آورده شدهاست:
الکترون (-ne) در معادله بالا میتواند از اکسیداسیون یک عامل کاهنده شیمیایی فراهم میشود. در اصل همیشه در یک فرآیند اکسایش-کاهش شیمیایی، دو ترکیب شیمیایی در کنار یکدیگر اکسید و احیا میشوند. ترکیبی که اکسید میشود الکترون آزاد میکند و لذا کاهنده نامیده میشود. در مقابل میتوان گفت که ترکیب دوم (در اینجا یون فلزی به عنوان اکسنده) باعث اکسیداسیون عامل کاهنده میشود. اینکه دو ماده در کنار یکدیگر در طی یک فرآیند اکسید و احیا نقش الکتروندهنده و الکترونگیرنده را بازی کنند به پتانسیل استاندارد الکترودی[۱۸] (E0) مربوط است. این کمیت (E0) در اصل شاخصی از تمایل ترکیب شیمیایی جهت گرفتن و یا آزاد کردن الکترون است که از جداول مربوطه در کتب شیمی تجزیه قابل استخراج است.
۳-۳- فرایند ابکافت
در فرآیند آبکافت، با افزایش یک مولکول آب در ساختار مولکول شیمیایی، شکست در پیوند خاصی از مولکول اولیه اتفاق میافتد. بهبیان سادهتر با دخالت یکمولکول آب، مولکول اولیه (معمولا) به دو بخش میشکند. در بسیاری موارد مولکول آب نیز خود میشکند و هر جزء آن به بخشی از مولکول اولیه متصل میشود. حتی در محیط آبی خالص نیز، آب به یونهای هیدروکسیل (-Hydroxyl, OH) و هیدرونیوم (+Hydronium, H3O) تفکیک میشود. گاه یونهای هیدرونیوم بهراحتی به صورت یون پروتون (+Proton, H) نمایش داده میشوند. واکنش تفکیک مولکولهای آب در زیر آمده است:
همچنین شکل ۱، فرآیند آبکافت را برای یک مولکول بزرگتر نشان میدهد.
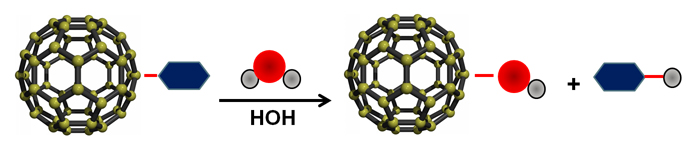 شکل ۱- شمایی از فرآیند آبکافت یک گروه عاملی بر سطح ابرمولکول فولرن
شکل ۱- شمایی از فرآیند آبکافت یک گروه عاملی بر سطح ابرمولکول فولرن
آبکافت یکی از مراحل پایهای در روش سنتزی سل-ژل است. این فرآیند به طور گستردهتر در مقاله اختصاصی "سنتز نانوذرات با روش سل-ژل" آورده شده است. همچنین فرآیند آبکافت در بسیاری موارد در مورد کاتیونهای فلزی اتفاق میافتد. شمایی از این فرآیند در شکل زیر (شکل ۲) آمده است:
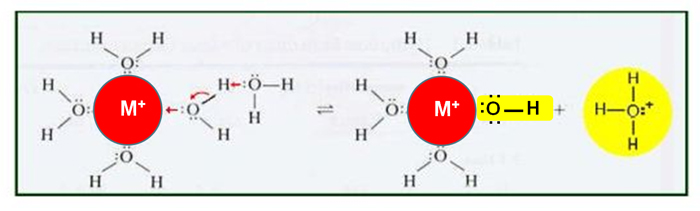 شکل ۲- فرآیند آبکافت برای یونهای فلزی
شکل ۲- فرآیند آبکافت برای یونهای فلزی
در این مورد یون فلزی آبپوشیده[۱۹] معمولا در نهایت (بسته به pH محیط) به هیدروکسید فلز تبدیل میگردد. در بسیاری موارد، هیدروکسید فلزی پیشماده مناسبی برای سنتز اکسیدهای فلزی است. تبدیل هیدروکسید به اکسید فلزی معمولا با فرآیندهای تخریب حرارتی صورت میگیرد. تبدیل مستقیم تیتانیوم کلرید (TiCl3) به اکسید تیتانیوم (TiO2) بر اثر آبکافت در حضور NH4OH اتفاق میافتد.
۴-۳- فرایند گرماکافت
واکنش گرماکافت یا گاه تحت عنوان تخریب حرارتی، به تخریب شیمیایی و برگشتناپذیر یک ماده در دمای بالا اطلاق میشود. اگر محصول باقیمانده از این فرآیند یک رسوب جامد باشد (مانند فرآیند تخریب حرارتی کمپلکسهای فلز-آلی کربونیل فلزات)، میتواند به عنوان رویکردی جهت سنتز نانومواد مورد بررسی قرار گیرد. مقاله "سنتز نانوذرات با روش تخریب حرارتی" بهطور مناسبی این مبحث را پوشش داده است.
۵-۳- فرایند بسپارش
در طی فرآیند بسپارش (پلیمریزاسیون)، مولکولهای اولیه با پیوند شیمیایی بهیکدیگر متصل شده و یک درشتمولکول را ایجاد میکنند. به مولکولهای اولیه تکپار[۲۰] و به مولکول نهایی بسپار[۲۱] میگویند. فرآیندهای بسپارش میتوانند افزایشی[۲۲] و یا تراکمی[۲۳] باشند. در فرآیند بسپارش افزایشی، مولکولهای اولیه به سادگی به یکدیگر افزوده میشوند اما در بسپارش تراکمی این اضافهشدن با از دست دادن مولکولهای ساده (مثل آب، الکل و ...) همراه است. شکل ۳ هردونوع فرآیند بسپارش را نمایش میدهد:
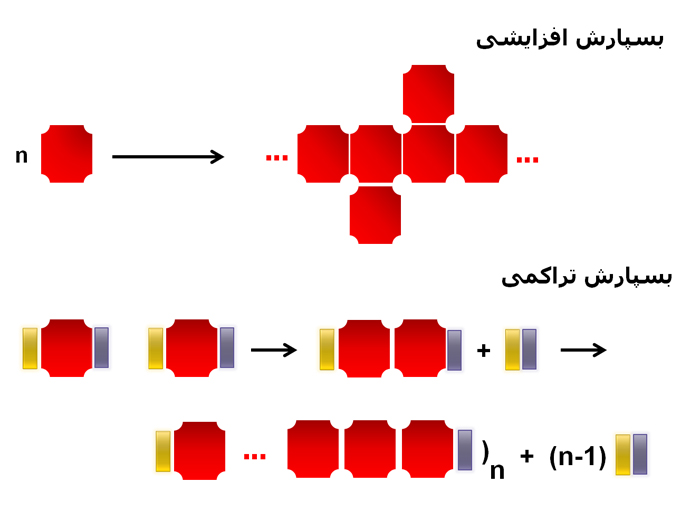 شکل ۳- شمایی از واکنشهای بسپارش افزایشی و بسپارش تراکمی
شکل ۳- شمایی از واکنشهای بسپارش افزایشی و بسپارش تراکمی
نانوذرات پلیمری بهخصوص در نانوپزشکی با استقبال فراوانی مواجه شدهاند و این به دلیل زیست سازگاری و کاربرد گسترده آنها در فرآیندهای انتقال دارو[۲۴] میباشد.
۶-۳- فرایند تراکم
بهطور کلی در فرآیند تراکم با اتصال مولکولهای تکپار به یکدیگر، مولکولهایی بهعنوان محصول جانبی ایجاد میشوند. اگر مولکول آزاد شده آب باشد، این فرآیند عکس واکنش آبکافت بهحساب میآید (در فرآیند آبکافت، بر اثر جذب آب، پیوند شیمیایی در مولکول شکسته میشود و در فرآیند تراکم، تشکیل پیوند باعث آزادسازی مولکول آب میشود). این فرآیند پایهایترین مرحله در فرآیند سل-ژل است. معمولا این مرحله همزمان و یا پس از فرآیند آبکافت اتفاق میافتد و منجر به تشکیل ساختارهای درشتمولکول بهعنوان محصول میشود. بر اثر این پدیده، محلول اولیه (سل) به مرور دارای گرانروی بیشتر میشود و بهسمت فاز جامد حرکت میکند. معمولترین مثال از این روند فرآیند تراکمی گروههای سیلانول (Si-OH) و تشکیل شبکه SiO2 میباشد. گروههای سیلانول خود حاصل آبکافت گروههای آلکوکسید (Si-OR) است. در شکل زیر این واکنش آورده شده است.
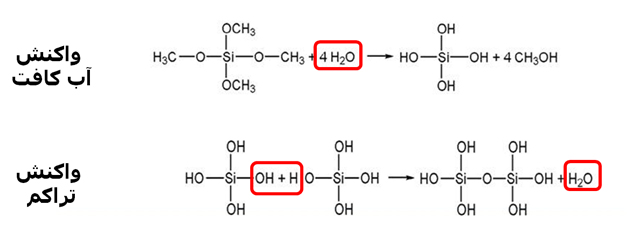 شکل ۴- واکنش تراکم و آبکافت به عنوان پایهایترین فرآیندها در روش سنتزی سل-ژل
شکل ۴- واکنش تراکم و آبکافت به عنوان پایهایترین فرآیندها در روش سنتزی سل-ژل
۴- جمعبندی و نتیجهگیری
سنتزهای شیمیایی از مطلوبترین روشهای ساخت نانوذرات هستند. این روشها که به روشهای سنتز تر نیز معروفند، بر پایه ترسیب ترکیبی با حلالیت کم از محلولهای آبی و غیر آبی عمل میکنند. از این دسته میتوان به روشهای سنتزی هم رسوبی، سنتز در میکروامولسیون، سنتز با گرماکافت، روش سل-ژل و روشهای سولوترمال-هیدروترمال اشاره نمود. علاوه بر واکنشهای رسوبی معمول که در شیمی واکنشهای جانشینی خوانده میشوند، واکنشهایی نظیر اکسایش-کاهش نیز در روند سنتز نانوذرات بهکار گرفته میشوند. همچنین روشهای شیمیایی سنتز نانوذرات میتوانند فرآیندهایی همچون آبکافت، تراکم، بسپارش و گرماکافت مولکولهای پیشماده را در بر بگیرند. در مقالات اختصاصی مربوط به هر روش سنتزی، این مباحث به صورت مبسوطتر توضیح داده شدهاست.
۵- منابـــع
[1]. Cui, H, Feng, Y., Ren, W., Zeng, T., Lv, H., Pan, Y., “Strategies of Large Scale Synthesis of Monodisperse Nanoparticles”, Recent Patents on Nanotechnology, Vol. 3, pp. 32-41, (2009).
[2]. Cushing, B.L., Kolesnichenko V.L., O'Connor, C.J., “Recent Advances in the Liquid-Phase Syntheses of Inorganic Nanoparticles”, Chemical Reviews, Vol. 104, pp. 3893-3946 (2004).
[3]. Skoog D.A., West D.M., Holler F.J., Crouch S.R., “Fundamentals of Analytical Chemistry”, 8th Edition, USA, Thomson Learning, (2004).
[4]. چالز مورتیمر، شیمی عمومی ،ترجمه علی پورجوادی، احمد خواجهنصیر طوسی، منصور عابدینی، عبدالجلیل مستشاری، جبار نفیسی موقر، چاپ هشتم، جلد اول و دوم، تهران، مرکز نشر دانشگاهی (۱۳۸۰).
[5]. عبدالرضا سیمچی، آشنایی با نانوذرات (خواص، روشهای تولید و کاربرد)، چاپ اول، تهران، موسسه انتشارات علمی دانشگاه صنعتی شریف (۱۳۸۷).
[6]. مسعود صلواتی نیاسری، زینب فرشته، نانوشیمی، روشهای ساخت، بررسی خواص و کاربردها، چاپ اول، تهران،انتشارات سخنوران (۱۳۹۰).
۶- پاورقی
[1] Monodisperse
[2] Wet Synthesis Methods
[3] Solution Phase Synthesis
[4] Thermal Decomposition
[5] Solvothermal and Hydrothermal
[6] Chemical Precipitation Synthesis
[7] Co-precipitation
[8] Precipitation
[9] Redox
[10] Hydrolysis
[11] Thermolysis
[12] Polymerization
[13] Condensation
[14] Contour Ion
[15] Spectator Ion
[16] Oxalates
[17] Chalcogenides
[18] Standard Electrode Potential
[19] Hydrated
[20] Monomer
[21] Polymer
[22] Addition Polymerization
[23] Condensation Polymerization
[24] Drug Delivery