سهشنبه 07 مرداد 1399 کد خبر: 3

یکی از رویکردهای سنتز نانومواد، رویکرد پایین به بالاست که طبق آن با قرارگرفتن اجزا سازنده نانومواد مانند اتمها در کنار یکدیگر یک نانوماده ایجاد میشود. یکی از روشهای سنتز طبق رویکرد پایین به بالا، روش احیا شیمیایی است که برای ساخت نانوذرات از آن استفاده میشود. در این روش سه جز اساسی وجود دارد که عبارتند از پیشماده فلزی، عامل احیاکننده و عامل پایدارکننده. با توجه به انتخاب هر یک از این سه عامل و کنترل شرایط سنتز میتوان شکل، ترکیب و اندازه نانوذرات فلزی را کنترل نمود. در ادامه با مبانی این روش و نقش هریک از اجزای مذکور بیشتر آشنا میشوید.
۲- مفهوم اکسایش و کاهش
قبل از هر چیز برای فهم این روش باید با مفهوم اکسایش و کاهش آشنا شد. در اینجا به صورت مختصر این مفهوم صرفا برای فهم واکنش در این روش سنتز گفته میشود. به صورت کلی واکنشهای اکسایش و کاهش (یا احیا) به واکنشهای شیمیایی گفته میشود که در طی آن عدد اکسایش اتم مورد بررسی تغییر کند. در این روش، از دست دادن یا گرفتن الکترون مهم است، بنابراین بر همین اساس مثالهایی از واکنشهای اکسایش و کاهش در ادامه آورده شده است:
واکنشهای اکسایش:
واکنشهای کاهش:
همانطور که در واکنشهای بالا مشاهده میشود، اتم در اثر از دست دادن الکترون اکسایش مییابد (اکسید میشود) و در اثر گرفتن الکترون کاهش مییابد (احیا میشود یا اصطلاحا کاهیده میشود). در روش احیا شیمیایی همانطور که از اسمش پیداست احیا (یا همان کاهش) اتفاق میافتد [۱].
۳- روش احیا شیمیایی
در روش احیا شیمیایی ابتدا یک پیشماده فلزی در یک حلال مناسب حل میشود. در اثر حل شدن پیشماده فلزی، کاتیونهای فلزی در محیط حلال پخش میشوند. در ادامه عامل کاهندهای به حلال اضافه میشود و با فراهم کردن الکترون، باعث احیا کاتیونهای فلزی و خنثی شدن آنها میشود. این امر به این دلیل است که برای تشکیل نانوذرات نیاز است تا تعدادی از اتمهای فلزی به یکدیگر بچسبند و یک هسته تشکیل دهند و در ادامه هستهها رشد کنند. اما در صورتیکه در حلال صرفا کاتیونهای فلزی وجود داشته باشد، در اثر دافعه الکترواستاتیکی هرگز این اتفاق نخواهد افتاد. در نتیجه با اضافه کردن عامل کاهنده، کاتیونهای فلزی خنثی شده و هستهزایی و رشد میتواند اتفاق بیفتد.
در ادامه که هستهزایی و رشد (برای آشنایی بیشتر با هستهزایی و رشد میتوانید به مقالات مرتبط مراجعه کنید) اتفاق افتاد، بزرگتر شدن نانوذرات اتفاق میافتد و در صورتیکه از آن جلوگیری نشود، این رشد به قدری پیش میرود که ابعاد ذرات از مقیاس صد نانومتر بیشتر میشود. برای جلوگیری از این امر از عوامل پایدارکننده استفاده میشود. این عوامل پایدارکننده که معمولا پلیمر هستند با قرارگیری در اطراف نانوذرات از رشد آنها جلوگیری میکنند و تعیین میکنند که نانوذرات تا چه اندازهای رشد کنند. این مراحل در شکل1 نمایش داده شده است [۲].
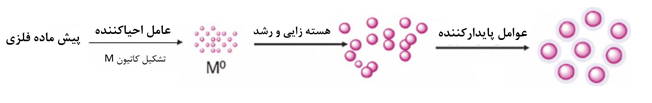
شکل۱- فرآیند روش احیا شیمیایی [۳]
در شکل ۱ ترتیب اضافهکردن پیشماده فلزی، احیاکننده و پایدارکننده به محلول مشاهده میشود. در ادامه هر یک از اجزای گفته شده بیشتر توضیح داده شده و مثالی نیز در این باره ذکر میشود.
۱-۳- پیشماده فلزی
در شکل2 برخی از پیشمادههای فلزی مرسوم در این روش نمایش داده شده است. در برخی از موارد از آندهای فلزی به این منظور استفاده میشود که میتوان با اختلاف پتانسیل الکتریکی کاتیونهای فلزی را از سطح آنها آزاد نمود (معمول نیست). ولی در اکثر موارد در ترکیباتی همچون نمکهای فلزی استفاده میشود که با حلشدن در یک حلال مناسب (معمولا آب) کاتیونهای فلزی را در آب آزاد میکنند. همانطور که از جدول1 مشاهده میشود از مرسومترین فلزاتی که در این روش به کار میروند میتوان به طلا، نقره، پلاتین، پالادیوم، رودیوم، نیکل و کبالت نام برد [۲].
جدول۱- برخی پیشمادههای فلزی مرسوم که در روش احیای شیمیایی به کار میروند [۲]
|
نام پیش ماده |
فرمول شیمیایی |
|
آند فلزی (کبالت، نیکل، پالادیم) |
Pd, Ni, Co |
|
کلرید پالادیم |
PdCl2 |
|
هیدروژن هگزا کلرو پلاتین |
H2PtCl6 |
|
پتاسیم هگزا کلرو پلاتین |
K2PtCl6 |
|
نیترات نقره |
AgNO3 |
|
تترااکسی کلرات نقره |
AgClO4 |
|
کلروآریکاسید |
HAuCl4 |
|
رودیوم کلرید |
RhCl3 |
۲-۳- عامل احیاکننده (کاهنده)
در جدول۲ برخی از احیاکنندههای مرسوم نمایش داده شده است. قدرت کاهندگی هرکدام از این عوامل احیاکننده با یکدیگر متفاوت است و باتوجه به انتخاب هریک از آنها نانوذره فلزی نهایی میتواند از لحاظ اندازه، توزیع اندازه و شکل متفاوت باشد. برخی از این عوامل احیاکننده همچون سدیم تتراهیدروبورات قدرت بالایی دارند و به سرعت میتوانند الکترونهای لازم برای احیا کاتیون فلزی را فراهم کنند و بعضی از این ترکیبات همچون عوامل احیاکننده گیاهی قدرت کمی دارند و به مرور این الکترونها را فراهم میکنند. باتوجه به دوستدار محیط زیست بودن و همچنین قیمت مناسب، تحقیقات زیادی بر روی عوامل احیاکننده گیاهی در سنتز نانوذرات فلزی انجام شده و در حال انجام است [۲].
جدول۲- برخی از عوامل احیاکننده مرسوم [۲]
|
فرمول شیمیایی ماده |
نام ماده |
|
H2 |
هیدروژن |
|
Na3C6H5O7 |
سدیم سیترات |
|
NH4OH + HCl |
هیدروکسیل امین هیدروکلرید |
|
C6H8O7 |
سیتریک اسید |
|
CO |
مونوکسیدکربن |
|
P |
فسفر داخل اتر |
|
CH3OH |
متانول |
|
H2O2 |
آب اکسیژنه |
|
Na2CO3 |
سدیم کربنات |
|
NaOH |
سدیم هیدروکسید |
|
HCHO |
فرمالدهید |
|
NaBH4 |
سدیم تتراهیدروبورات |
|
-NH4 |
یون آمونیوم |
۳-۳- عامل پایدارکننده
همانطور که در جدول۳ نشان داده شده است از ترکیبات پلیمری مختلفی جهت پایدارسازی نانوذرات فلزی و جلوگیری از رشد بیش از اندازه آنها و همینطور کلوخهای شدن آنها استفاده نمود. این عوامل طبق مکانیزم ممانعت فضایی (در مقالات پایدارسازی نانومواد توضیح داده شده است) نانوذرات فلزی را پایدار میکنند. باتوجه به اینکه در این روش معمولا از حلالهای قطبی مثل آب استفاده میشود اکثر این پلیمرها، پلیمرهایی قطبی هستند تا بتوانند در آن حلال قطبی حل شده و دور نانوذرات قرار گیرند. انتخاب نوع پلیمر بستگی به قطبیت حلال و کاربرد مورد نظر دارد [۲].
جدول۳- برخی از عوامل پایدارکننده مرسوم [۲]
|
نام ماده |
واژه معادل انگلیسی |
|
پلیوینیلپیرولیدون PVP |
(Poly (vinylpyrrolidone |
|
پلیوینیلالکل PVA |
Polyvinylalcohol |
|
پلیاتیلنآمین |
Polyethyleneimine |
|
سدیم پلیفسفات |
Sodium polyphoshate |
|
سدیم پلیاکریلات |
Sodium polyacrylate |
|
تتراآلکیلآمونیوم هالوژنید |
Tetraalkylammoniumhalogenides |
۴-۳- بیان یک مثال از روش احیا شیمیایی
به عنوان مثالی از روش احیا شیمیایی میتوان به سنتز نانوذرات نقره اشاره کرد. در این روش ابتدا یک محلول با مولاریته مشخص از پیشماده نقره (مثل نیترات نقره) در آب دییونیزه تهیه میشود. در ادامه محلول دیگری با مولاریته مشخص از عامل احیاکننده (همچون سدیم تترا هیدروبورات) در آب دییونیزه تهیه میشود. در ادامه محلول حاوی کاهنده به محلول اولیه حاوی کاتیونهای نقره اضافه میشود و هستهزایی و رشد اتفاق میافتد. همچنین از عامل پایدارکننده مناسبی همچون پلیوینیل الکل نیز در محلول نهایی استفاده میشود تا رشد نانوذرات فلزی کنترل شده و از کلوخهای شدن آنها جلوگیری شود.
واکنش مذکور هم در دماهای بالا همچون ۹۰ درجه سانتیگراد میتواند اتفاق بیافتد و هم در دماهای پایین همچون ۴- درجه سانتیگراد. انتخاب دما بستگی به شرایط آزمایش همچون قدرت کاهنده دارد. در دماهای بالا، احیا کاتیون فلزی و به تبع آن هستهزایی و رشد سریعتر اتفاق میافتد و ممکن است در صورت قوی بودن عامل کاهنده کنترل بر روی نانوذره نهایی کاهش یابد.
همچنین در سنتز مذکور عوامل مختلفی بر روی اندازه و شکل نانوذرات فلزی تاثیر دارند. از جمله این عوامل میتوان به موارد زیر اشاره کرد:
وجود مقادیر بیشتر عامل کاهنده یا عامل کاهنده با قدرت احیا بالاتر به ایجاد اتمهای خنثی فلزی بیشتر (در اثر نرخ واکنش بالاتر) در طول زمان و هستهزایی بالاتر میشود. هستهزایی بالاتر نیز باتوجه به محدود بودن غلظت باعث رشد محدودتر هر هسته و در نتیجه اندازه کمتر نانوذرات میشود [۴و۲].
در شکل۲ تاثیر غلظت پیشماده فلزی بر تعداد هستههای ایجادی و متوسط سایز نانوذرات فلزی نشان داده شده است. مطابق این شکل در صورتیکه غلظت پیشماده فلزی از غلظت استاندارد تعیین شده برای آن دو برابر شود، میانگین اندازه نانوذرات کمتر شده و در صورتی که غلظت آنها نصف غلظت استاندارد شود، میانگین اندازه نانوذرات افزایش پیدا میکند. دلیل این امر در نمودار تعداد هستهها بر حسب زمان در سه غلظت مذکور برای پیشمادههای فلزی نشان داده شده است. مطابق این نمودار، افزایش غلظت پیشماده فلزی منجر به هستهزایی بیشتر میشود و هستهزایی بیشتر نیز به کم شدن متوسط سایز نانوذرات فلزی میانجامد [۵].
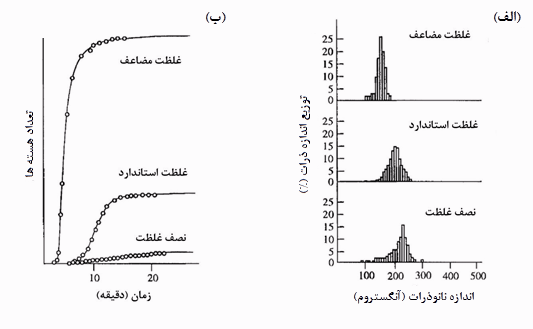
شکل۲- (الف) متوسط اندازه نانوذرات فلزی با تغییر غلظت پیشماده فلزی (ب) تعداد هستههای ایجادی بر اساس غلظت پیشماده فلزی [۵]
در صورتیکه عامل کاهنده به صورت ناگهانی اضافه شود، به علت اینکه در یک زمان تعداد قابل توجهی کاتیون خنثی میشوند و میتوانند هسته ایجاد کنند، هستهزایی با نرخ بالایی انجام میشود. هستهزایی بیشتر به توزیع اتمهای خنثی شده فلزی (با غلظت محدود) بر روی تعداد بیشتری هسته میشوند که در نتیجه به رشد کمتر هر کدام از هستهها و اندازه کوچکتر نانوذرات میانجامد. البته در این امر ماده پایدارکننده نیز تاثیر به سزایی دارد. همچنین ناگهانی اضافهکردن عامل کاهنده باعث ایجاد نانوذرات با شکلهای غیریکنواخت میشود چراکه اتمهای خنثی شده فلزی با مقادیر زیاد به صورت ناگهانی ایجاد شده و بر روی هستهها جذب شدهاند. برعکس این حالت اگر محلول حاوی عامل کاهنده به آرامی به محلول حاوی پیشماده فلزی اضافه شود، احتمال ایجاد نانوذرات با اندازه بزرگتر و شکل یکنواختتر بیشتر است. قابل ذکر است که سرعت اضافه کردن عامل کاهنده تنها یکی از پارامترهای تاثیرگذار است و صرفا بر اساس آن نمیتوان بر روی سایز و شکل نانوذرات قضاوت نمود و سایر پارامترها را نیز باید در نظر گرفت.
احیا ممکن است در یک مرحله یا در چند مرحله رخ دهد. برای مثال پیشماده فلزی ابتدا با مادهای واکنش دهد و یک ترکیب دیگر مثل هیدروکسید فلزی ایجاد شود و سپس با عامل کاهندهای همچون هیدروژن تبدیل به اتم خنثی شود. اینکه این فرآیند در چند مرحله انجام شود بر اندازه و شکل تاثیرگذار است [۶].
۴- جمعبندی و نتیجهگیری
روش احیا شیمیایی یکی از روشهای سنتز پایین به بالا برای سنتز نانوذرات فلزی است. در این روش با کاهش کاتیون فلزی در یک حلال مناسب و استفاده از پلیمر پایدارکننده، نانوذرات فلزی با اندازه و شکل موردنظر سنتز میشوند. از جمله عوامل مهمی که در این روش تعیین کننده هستند میتوان به نوع و غلظت پیشماده فلزی، قدرت احیاکنندگی عامل کاهنده، دمای واکنش، زمان واکنش و نوع پلیمر پایدارکننده اشاره کرد. در صورتی که تمامی موارد به خوبی کنترل شوند میتوان نانوذرات فلزی با توزیع اندازه باریک، اندازه و شکل مشخص سنتز نمود.
۵- مراجع
[1] Mortimer, Charles E. "Chemistry; a conceptual approach." (1967).
[2] Guozhong, Cao. Nanostructures and nanomaterials: synthesis, properties and applications. World scientific, 2004.
[3] Arvizo, Rochelle R., et al. "Intrinsic therapeutic applications of noble metal nanoparticles: past, present and future." Chemical Society Reviews 41.7 (2012): 2943-2970.
[4] Liang, Wenjie, et al. "Kondo resonance in a single-molecule transistor." Nature 417.6890 (2002): 725.
[5] Turkevich, John. "Colloidal gold. Part I." Gold Bulletin 18.3 (1985): 86-91.
[6] Chou, Kan-Sen, and Chiang-Yuh Ren. "Synthesis of nanosized silver particles by chemical reduction method." Materials chemistry and physics 64.3 (2000): 241-246.