پنجشنبه 03 مهر 1399 کد خبر: 13
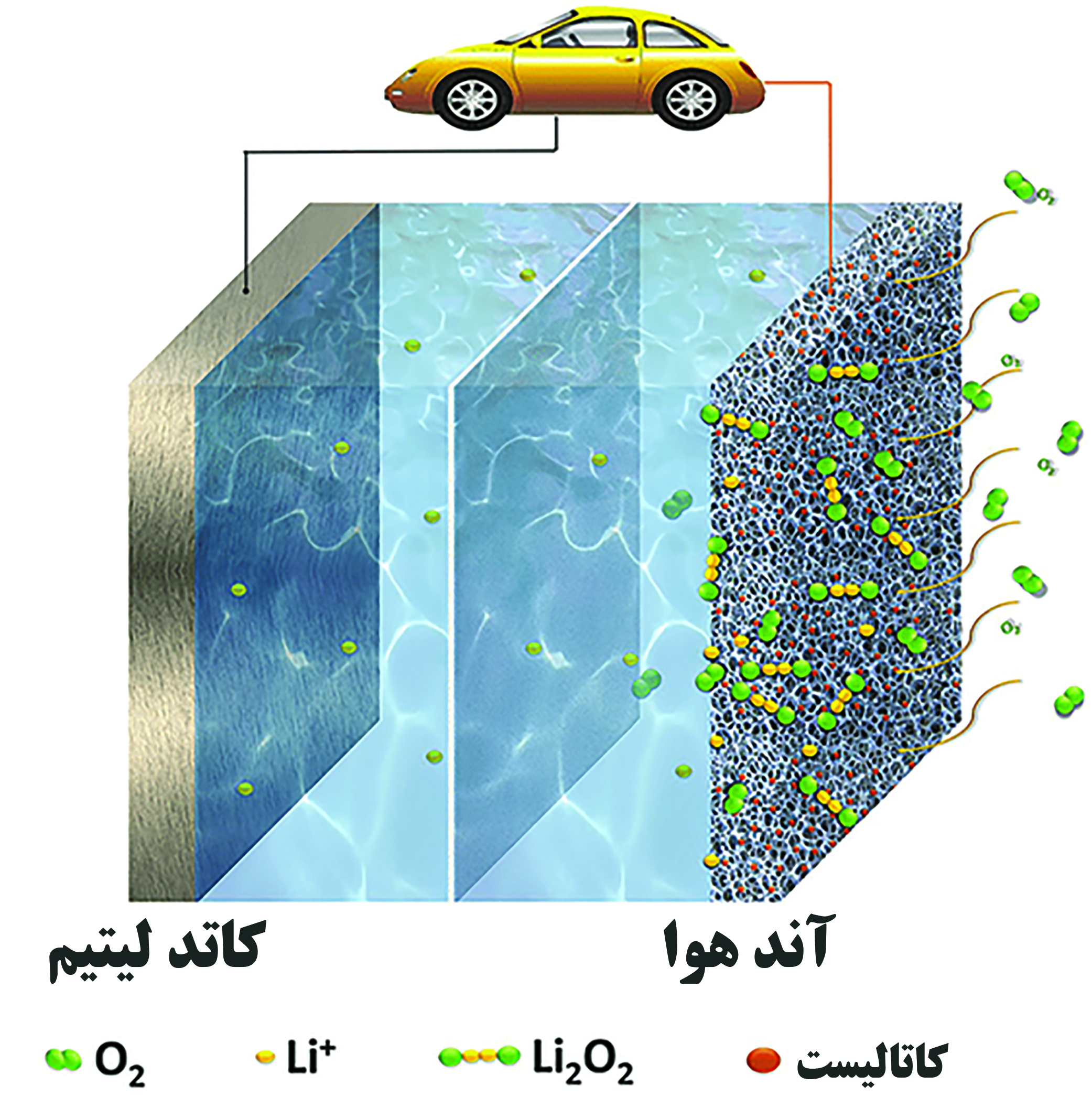
با توجه به نیاز بشر برای ذخیره انرژی، باتریهای متنوعی ساخته شده و استفاده میشوند. باتری لیتیم-یون متداولترین باتری برای استفاده در وسایل الکترونیکی قابل حمل میباشد؛ اما این باتری محدودیتهایی نیز دارد. حداکثر چگالی انرژی قابل دسترسی در باتریهای لیتیم-یون برابر با ۲۵۰ وات ساعت بر کیلوگرم میباشد که کاربرد این باتری در وسایلی که به باتریهایی با انرژی بالا نیاز دارند را دچار مشکل میکند. از میان باتریهای درحال توسعه، باتری لیتیم-هوا عملکرد بهتری را از خود نشان داده است و چگالی انرژی تئوری حدود ۱۰ برابر باتری لیتیم-یون دارد. در شکل ۱ چگالی انرژی باتریهای مختلف مقایسه شدهاند. در اینجا چگالی انرژی برابر با انرژی ذخیره شده در یک کیلوگرم از ماده میباشد. در گذشته به بررسی باطری ها و کاربرد فناوری نانو در آنها پرداختیم در این مقاله به بررسی مکانیزم باتری لیتیم-هوا و کاربرد فناوری نانو در اجزای آن پرداخته میشود .
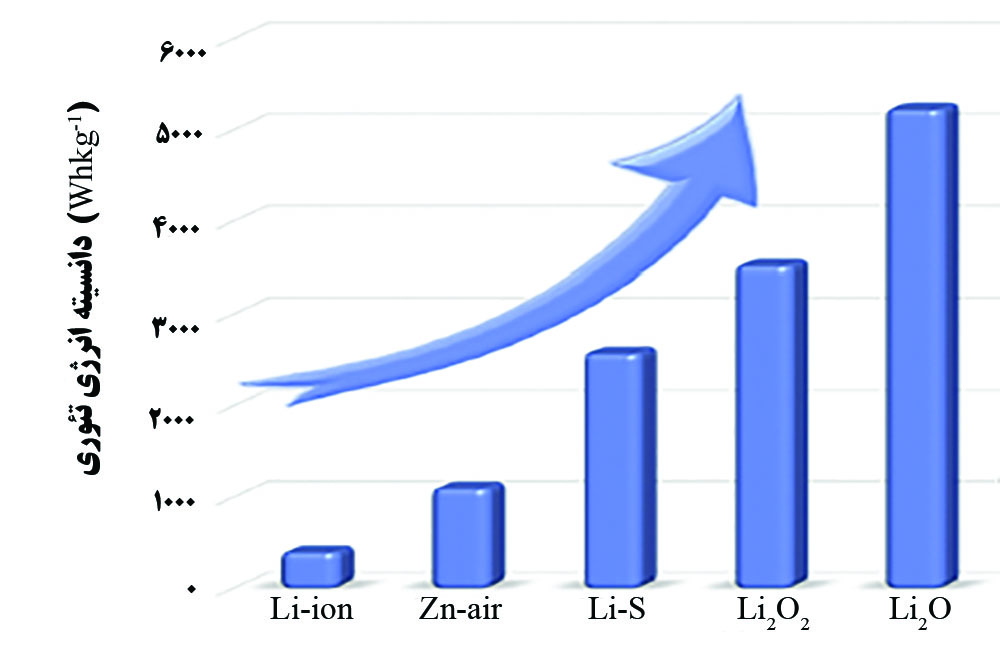
شکل ۱. مقایسه چگالی انرژی در باتریهای مختلف
اجزای باتری لیتیم-هوا بهطور کلی مشابه با باتری لیتیم-یون است. هر دو از آند فلزی لیتیم، الکترولیت، جداکننده و کاتد تشکیل شدهاند، با این تفاوت که کاتد باتری لیتیم-هوا در معرض اتمسفر قرار میگیرد. باتریهای لیتیم-هوا سیستمهای نیمهباز هستند که از اکسیژن هوا بهعنوان منبعی برای تولید انرژی استفاده میکنند. در فرایند دشارژ، فلز لیتیم به یون لیتیماکسید تبدیل میشود و سپس به کاتد هوا مهاجرت میکند. بهطور همزمان، اکسیژن الکترونهای مدار خارجی را دریافت کرده و با یون لیتیم واکنش میدهد. هنگام شارژ شدن باتری، فرایند الکتروشیمیایی برعکس میشود. واکنشهای الکتروشیمیایی به صورت زیر میباشند [۱]:
آند(اکسایش)
کاتد(کاهش)
واکنش کلی (۲/۹۶ ولت)
چهار نوع باتری لیتیم-هوا براساس الکترولیت مورد استفاده در آن وجود دارد. الکترولیت غیرآبی [۱]، الکترولیت آبی [۲]، الکترولیت هیبریدی(غیرآبی/ آبی) [۳] و الکترولیت حالت جامد [۴]. در بین چهار الکترولیت مورد استفاده، به دلیل چگالی انرژی بالا و ساختار ساده باتری بیشترین مطالعات بر روی الکترولیتهای غیرآلی صورت گرفته است. در شکل ۲ انواع این باتریها نشان داده شده است.
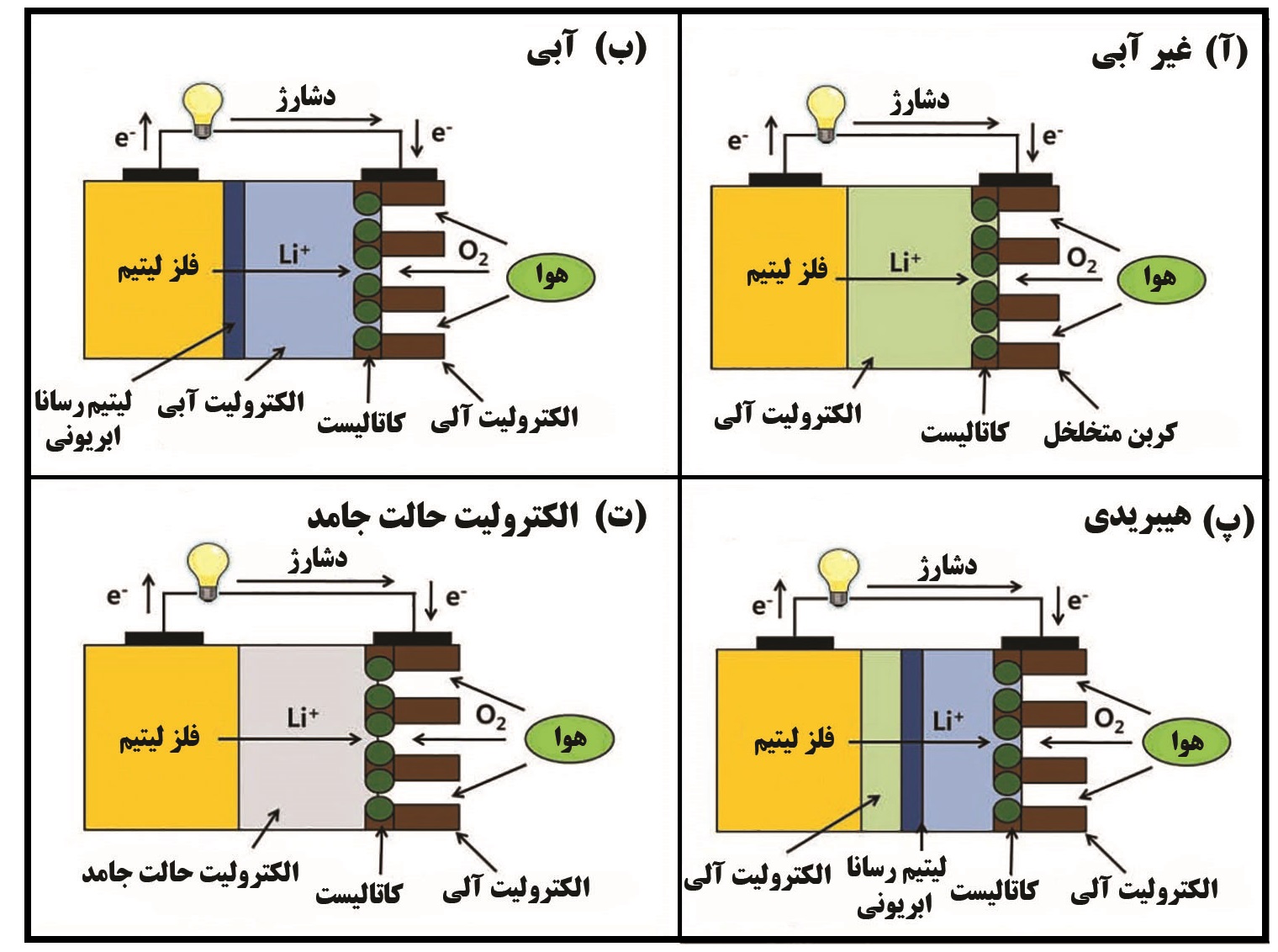
شکل ۲. شماتیک انواع باتریهای لیتیم-هوا براساس نوع الکترولیت. الف) غیرآبی. ب) آبی. پ)هیبریدی. ت) حالت جامد
با این وجود، موانعی برای استفاده گسترده از این باتریها وجود دارد؛ مانند بازده انرژی پایین، عمر چرخه کوتاه و سرعت عملیاتی کم. علت این محدودیتها بهطور کلی کندی واکنش با اکسیژن و سرعت پایین انتقال جرم در کاتد است [۱]. به منظور بهبود این مشکلات، پژوهشهای زیادی روی اجزای مختلف باتری لیتیم-هوا انجام شده است. در ادامه اجزای مختلف باتری و کاربرد فناوری نانو در هرکدام شرح داده شده است.
به دلیل وجود سیستم نیمهباز و مکانیزم پیچیده واکنش لیتیم و اکسیژن، کاتد مورد استفاده باید خواص ویژهای داشته باشد؛ از جمله فعالیت کاتالیستی بالا، رسانایی الکترونیکی بالا و تخلخل زیاد. فعالیت کاتالیستی بالا به منظور غلبه بر کندی واکنش لیتیم و اکسیژن ضروری است. رسانش الکتریکی قوی منجر به حرکت سریعتر الکترونها و افزایش سرعت واکنش میشود. وجود تخلخل زیاد در کاتد لازم است؛ زیرا محصولات تشکیل شده حین دشارژ در کاتد ذخیره میشوند. بهعلاوه تخلخل زیاد میتواند مشکل کم بودن سرعت انتقال جرم را نیز برطرف کند. کاتدهای مورد استفاده در باتریهای لیتیم-هوا را میتوان به سه دسته تقسیم کرد: مواد کربنی، مواد برپایه فلزات گرانبها و مواد برپایه فلزات غیرگرانبها.
کربن فعال[۵] مادهای است که به عنوان افزودنی رسانا به طور وسیعی در باتریها استفاده میشود. علاوه بر قیمت ارزان و رسانایی الکتریکی، این ماده سطح ویژه زیادی دارد (تا ۲۰۰۰ مترمربع برگرم). در پژوهشی نشان داده شده است که استفاده از کربن فعال با سطح ویژه بیشتر و اندازه تخلخل بزرگتر، عملکرد باتری را بهبود میدهد [۲]. همچنین یکسان بودن اندازه تخلخلها و بزرگتر بودن مزوتخلخلها [۶] باعث افزایش ظرفیت باتری میشود [۳].
همانطور که اشاره شد، کاتد باتریهای لیتیم-هوا به سطح ویژه بالا و تخلخل پایدار نیاز دارند. کاهش اندازه مواد یکی از راهحلهای کاربردی برای افزایش سطح در دسترس آنهاست. از این رو، استفاده از نانوساختارهای کربنی مانند نانولولههای کربنی و گرافن در باتریها مورد مطالعه قرار گرفته است. محققان توانستهاند با استفاده از نانولولههای کربنی چنددیواره در کاتد باتریهای لیتیم-هوا به ظرفیت بسیار بالای ۳۴۶۰۰ میلیآمپرساعت برگرم دست پیدا کنند. با کنترل پارامترهای تولید نانولولهها، میتوان ساختارهای نظم یافته نانولولهها را تولید نمود (شکل ۳). این نانولولههای مرتب و بدون اتصال با حفرات نظم یافته میتوانند بهطور موثری واکنشپذیری الکتروشیمیایی را افزایش دهند؛ همچنین دسترسی مداوم یونهای لیتیم با اکسیژن را برقرار کنند و با توزیع یکنواخت محصولات، مسدود شدن تخلخلها را به حداقل برسانند [۴].

شکل۳. تصویرSEMبا بزرگنماییهای متفاوت فیبرهای نانولوله کربنی به عنوان کاتد در باتری
گرافن، ماده دیگری است که میتوان از آن به عنوان کاتد استفاده کرد. رسانایی بالای گرافن و سطح ویژه آن (۲۶۳۰ مترمربع بر گرم)، باعث شده تا این ماده بتواند برای استفاده در کاتد، ایدهآل باشد. استفاده از ورقههای گرافن فعالیت کاتالیستی کاتد را به شدت افزایش میدهد. عملیات حرارتی گرافن منجر به افزایش پایداری چرخه میشود؛ زیرا تعداد پیوندهای دوگانه افزایش مییابد و گروههای عاملی روی سطح گرافن از بین میروند [۵]. در پژوهشی با استفاده از چارچوبهای سه بعدی گرافن [۷] به عنوان کاتد، ظرفیت دشارژ ۱۵۰۰۰ میلیآمپرساعت برگرم بهدست آمده است [۶]. دستیابی به این ظرفیت بالا دو علت اصلی دارد؛ نخست وجود تخلخل ویژه با کانالهای متعدد و بزرگ که میزان زیادی اکسیژن را برای واکنش فراهم میکند؛ و دلیل دیگر این است که ذرات لیتیمپراکسید تمایل دارند بر روی جای خالی گروههای عاملی روی سطح گرافن تشکیل شوند.
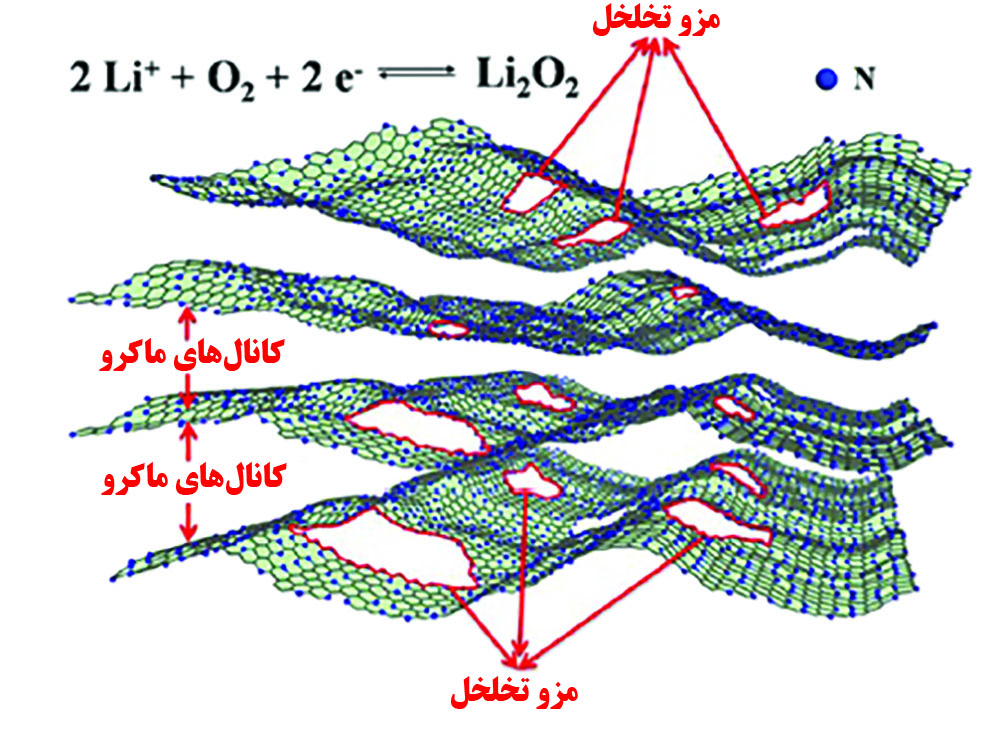
شکل ۴. ساختار منظم کربنی با کانالهای ماکرو و تخلخلهای مزو
با وجود موفقیتهایی که از طریق استفاده از نانوساختارهای کربنی در کاتد باتریهای لیتیم-هوا بدست آمده، باز هم سرعت کم واکنش لیتیم و اکسیژن مشکلی است که به خوبی برطرف نمیشود. دوپکردن [۸] عناصر در ساختارهای کربنی روشی کارآمد برای بهبود عملکرد کاتالیستی کاتد است. در پژوهشی نانولولههای کربنی که نیتروژن در آن دوپ شده بود سنتز شدند و نتیجه آن افزایش ظرفیت باتری نسبت به نانولولههای خالص بود [۷]. در پژوهشی دیگر ساختارهای منظم نیتروژن دوپشده در کربن به روش سل-ژل [۹] تولید شدند که در آن کانالهای ماکرو و مزوتخلخل به وجود آمده و عمر چرخهها را افزایش دادند (شکل۴). همچنین تشکیل ساختارهایی با هندسه منظم که نیتروژن در کربن دوپشده باشد، موجب افزایش جذب اکسیژن میشود و سرعت واکنش را افزایش میدهد [۸].
بهطورکلی دوپکردن نیتروژن راهی موثر برای افزایش قدرت کاتالیستی مواد کربنی است. دوپکردن موجب دستکاری ساختار الکترونی میشود و سایتهای فعال بیشتری را فراهم میکند. همچنین دوپکردن گوگرد باعث افزایش عمر چرخهها میشود و عملکرد آن بهتر از نیتروژن است زیرا پیوندهای کربن-گوگرد پایداری بیشتری از پیوندهای کربن-نیتروژن دارند [۹].
فلزات گرانبها کاتالیستهایی بسیار قوی برای افزایش سرعت واکنشها هستند. در پژوهشهای متعددی از این فلزات و اکسیدهای آنها در کاتد باتریهای لیتیم-هوا استفاده شده است. طلا، پلاتین، پالادیم، رودیم و ایریدیم متداولترین فلزات مورد استفاده در کاتد هستند [۱۳-۱۰]. در پژوهشی از طلای نانومتخلخل به عنوان کاتد استفاده شد و فرایند واکنش ۱۰ برابر سریعتر از کاتد کربنی اتفاق افتاد [۱۰]. همچنین میتوان از کامپوزیتهای این فلزات با نانوساختارهای کربنی و آلیاژ این فلزات در کاتد استفاده کرد.
به دلیل هزینه زیاد فلزات گرانبها، تلاشها درپی یافتن مواد ارزانتر برای استفاده در کاتد است. دراین راستا استفاده از فلزات واسطه و ترکیبات آنها روشی جایگزین است. فلزات واسطه به دلیل خاصیت کاتالیستی بالا، میتوانند کمک شایانی به حل مشکل واکنشپذیری لیتیم و اکسیژن کنند. نانوذرات کبالت متصل شده به نانولولههای کربنی عملکرد الکتروشیمیایی قابل توجهی از خود نشان میدهند و علت آن ایجاد سایتهای فعال بیشتر بر روی کربن است [۱۴]. در پژوهشی نانوذرات مس و کبالت بر روی گرافن قرار گرفتند و ظرفیت ۲۸۹۷۰ میلیآمپرساعت برگرم و با عمر چرخه بالا (تا ۲۰۰ چرخه) بدست آمد.
از میان اکسیدهای فلزات واسطه، کاتالیست اکسیدکبالت توجه بیشتری را به خود معطوف ساخته؛ زیرا قیمت آن پایین است، ترکیبات آن متنوع هستند و فعالیت کاتالیستی آن قابل مقایسه با فلزات نجیب میباشد. نشان داده شده است که وجود نقصهای بلوری جایخالی اکسیژن [۱۰] در ساختار اکسیدکبالت عمر چرخه را افزایش میدهند. در حضور این نقص بلوری، پس از اولین دشارژ، لیتیم پراکسید به صورت صفحهای تولید میشود و پس از هشتمین دشارژ، مجددا اندازه ذرات کوچک شده است (شکل ۵). همچنین وجود جایخالی اکسیژن در ساختار موجب افزایش رسانایی الکتریکی و تسهیل حرکت یونهای لیتیم و تشکیل سایتهای فعال میشود [۱۵]. روش ایجاد جایخالی اکسیژن در ساختار اکسید فلزات واسطه به منظور بهبود عملکرد الکتروکاتالیستی آنها انجام میشود و روشی مرسوم است.

شکل ۵. نانوذرات اکسیدکبالت با نقص جای خالی اکسیژن به عنوان کاتد، الف) قبل از دشارژ، ب) پس از اولین دشارژ، پ) پس از هشتمین دشارژ
با وجود پیشرفتهایی که در استفاده از فلزات واسطه حاصل شده، رسانایی الکتریکی ضعیف آنها همچنان یک معضل است. به همین دلیل پژوهشهایی بر روی کاربید فلزات واسطه انجام شده که رسانایی آنها بیشتر از اکسید فلزات میباشد. از میان کاربید فلزات مختلف، کاربید مولیبدن به دلیل ظرفیت چندگانه، فعالیت الکتروشیمیایی زیاد و هزینه مناسب بیشترین استفاده را داشته است [۱۶]. در پژوهشی کامپوزیت کربن پیچیده شده دور نانوذرات کاربید مولیبدن و نانولولههای کربنی بر روی فوم نیکل به عنوان کاتد مورد استفاده قرار گرفتهاند و عملکرد الکتروشیمیایی باتری را بهبود داده و عمر چرخه را تا ۳۰۰ چرخه افزایش دادهاند [۱۷]. در پژوهشی دیگر غشاهای متشکل از نانوسیمهای نیترید کبالت که بر روی نانوفیبرهای کربنی قرار گرفتهاند به عنوان کاتد استفاده شدند و باعث افزایش عمر چرخه و برگشتپذیری واکنش باتری گردیدند (شکل۶) [۱۸].
فعالیت کاتالیزوری مواد کاتدی یکی از مهمترین پارامترهایی است که بهطور مستقیم عملکرد الکتروشیمیایی باتریهای لیتیم-هوا را تعیین میکند. مواد مبتنی بر کربن، به ویژه مواد کربنی حاوی دوپشونده، دارای هدایت الکتریکی بالا، تخلخل قابل تنظیم و هزینه کم هستند. با این حال، فعالیت کاتالیزوری و عمر چرخه در آنها به اندازه کافی خوب نیست. در مقابل، مواد مبتنی بر فلز معمولاً فعالیت کاتالیزوری بالایی را نشان میدهند. با این حال، فلزات گرانبها هزینه بالایی دارند، اکسیدهای فلزی رسانایی الکترونیکی پایینی دارند و فلزات و ترکیبات آنها قابلیت کلوخه شدن دارند. بنابراین، کامپوزیتهای مواد فلزی و کربن میتوانند بسیاری از برتریهای منحصر به فرد بدون محدودیت در جهت بهبود هدایت الکترونیکی، ایجاد سایتهای فعال زیاد، پراکندگی نانوذرات و افزایش سطح ویژه را به ارمغان آورند.
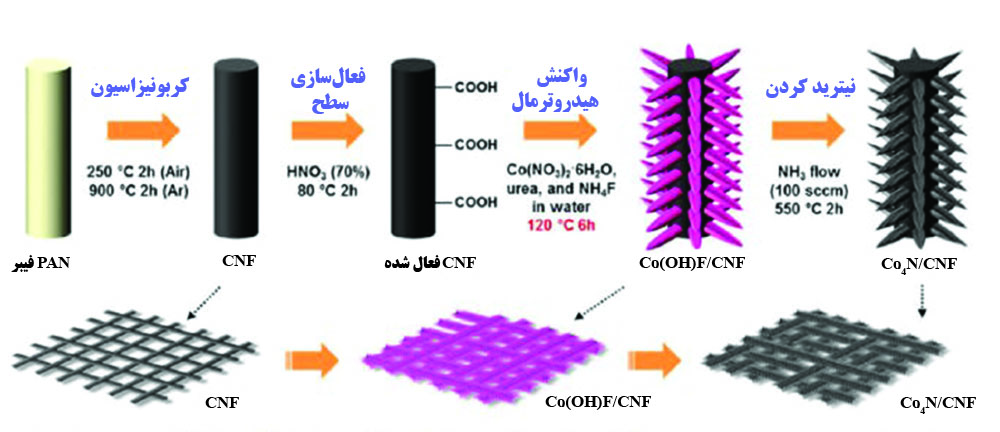
شکل ۶. غشای تولید شده از نانوسیمهای نیترید کبالت
چگالی انرژی بالاتر و پایداری چرخه بیشتر، دو هدف اصلی سیستمهای ذخیره انرژی هستند. در باتریهای لیتیم-هوا، ماده فعال اکسیژن بهطور نامحدود در اتمسفر وجود دارد؛ بنابراین ظرفیت باتری به میزان لیتیمی که آند در اختیار سیستم قرار میدهد بستگی دارد. فلز لیتیم ظرفیت تئوری ۳۸۶۰ میلیآمپرساعت برگرم دارد و میتواند چگالی انرژی زیادی را برای سیستم تولید کند. با این حال آند لیتیم محدودیتهایی نیز دارد. فلز لیتیم با مشکلاتی همچون عدم پایداری الکترولیت جامد بین فازی [۱۱]، تغییرات حجمی و کاهش پایداری چرخه مواجه است. متداولترین روش برای بهبود فلز لیتیم، ایجاد نانوپوششهایی بر روی سطح آن است. دو نوع پوشش برای این فلز استفاده میشود؛ لایه الکترولیت جامد بین فازی و لایههای مصنوعی. در روش اول، افزودنیهایی به الکترولیت اضافه میشوند تا الکترولیت جامد بین فازی پایدار تشکیل شود. برای مثال، لیتیمنیتریت ماده مناسبی برای افزودن به الکترولیت میباشد [۱۹]. در روش دوم، یک غشای اضافی بر روی فلزلیتیم قرار داده میشود. در پژوهشی لایهای از پلیمر و آلومینیوماکسید برای جلوگیری از تغییر ساختار الکترولیت بر روی سطح لیتیم، ایجاد شد. با ایجاد این لایه محافظ، عمر چرخه تا سه برابر نسبت به آند بدون پوشش افزایش یافت [۲۰]. در پژوهشی دیگر، با استفاده از روش بسیار ساده لایهنشانی غوطهوری [۱۲] لایه نازک پلیمری بر روی فلز لیتیم ایجاد شد [۲۱].
اولین الکترولیت مورد استفاده در باتری لیتیم-هوا آمیزهای از اتیلنکربنات، پروپیلنکربنات و بوده است [۲۲]. ثابت شده است که الکترولیتهای بر پایه کربنات ناپایدارند و باعث تولید لیتیمکربنات به عنوان فرآورده جانبی میشوند که بازده باتری را کاهش میدهد [۲۳]. پس از آن، تحقیقات به الکترولیتهای بر پایه سولفوکساید روی آوردند؛ مزیت استفاده از آنها فرّار نبودن، ویسکوزیته پایین و نفوذ زیاد اکسیژن در آن است [۲۴]. مواد بر پایه اتر بیشترین کاربرد را در الکترولیت باتریهای لیتیم-هوا دارند؛ زیرا پایداری آنها در برابر گونههای سوپراکسید زیاد است و همچنین لیتیم و اکسیژن قابل حل شدن در آن هستند. به علاوه ولتاژ کاری پایدار آن تا ۴/۵ ولت است که این ولتاژ بالا برای رسیدن به عمر طولانیتر چرخه اهمیت دارد [۲۵].
مسئله مهم دیگر، تبخیر حلالهای آلی میباشد. الکترولیتهای حالت جامد [۱۳] میتوانند گزینه مناسبی برای برطرف کردن این مشکل باشند. همچنین استفاده از الکترولیت حالت جامد، مانع از حرکت گونههای پراکسید و سوپراکسید میشود که باعث محافظت از لیتیم در آند میشود. به علاوه با وجود این الکترولیتها، ایمنی باتری بیشتر میشود زیرا مواد آلی اشتعالپذیر در آن وجود ندارند [۲۶].
در بخشهای قبل، کاتالیستهای متعددی را برای باتریهای لیتیم-هوا معرفی کردیم؛ اما قدرت کاتالیستی این مواد به دلیل ارتباط ضعیف بین فرآوردههای دشارژ و کاتالیست، محدود میشود. این محدودیت هنگام رسیدن به انتهای هرکدام از فرآیندهای شارژ یا دشارژ، بیشتر خود را نشان میدهد. به عبارت دیگر، برخی از فرآوردههای دشارژ به دلیل دور بودن از ماده کاتالیست، نمیتوانند در واکنش کاتالیستی شرکت کنند. گونهی مهمی از الکتروکاتالیستها به نام واسطهای ردوکس [۱۴] میتوانند تولید و تجزیه فرآوردههای دشارژ را تسهیل کنند؛ زیرا در الکترولیت حل میشوند و با این مواد واکنش میدهند. در شکل ۷ مکانیزم تسهیلگری واسطهای ردوکس را مشاهده میکنید. در حین فرآیند شارژ، واسطها الکترونهای خود را در اختیار کاتد میگذارند و عدد اکسایش واسطها افزایش مییابد؛ سپس به فرآوردههای دشارژ نفوذ میکنند و آنها را به اکسیژن و یون لیتیم اکسید میکنند و به حالت اولیه خود باز میگردند. گونههای واسط متنوع آلی و غیر آلی وجود دارند [۲۹-۲۷]. بزرگترین محدودیت این واسطها، عبور ناخواسته آنها از جداکننده و واکنش با لیتیم آند است.
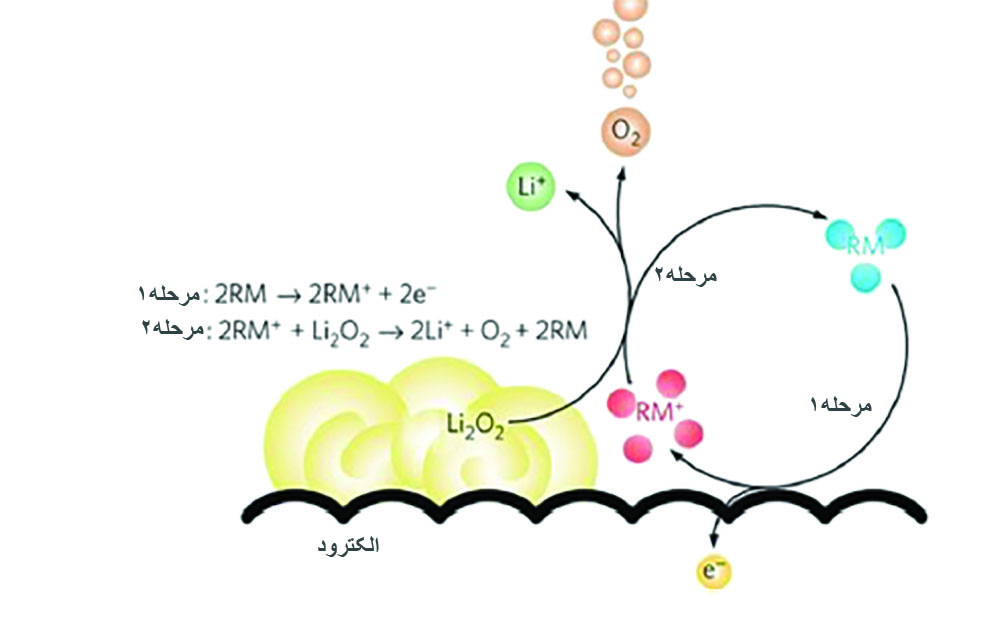
شکل ۷. مکانیزم تسهیلگری واسطهای ردوکس
دستیابی به فناوری ساخت باتری لیتیم-هوا در مقیاس صنعتی، به دلیل چگالی انرژی بالای آن، هدف بسیاری از پژوهشها میباشد. در این مقاله به بررسی سازوکار باتری لیتیم-هوا و اجزای مختلف آن پرداخته شد. نانوساختارها به علت سطح ویژه زیاد، گزینه مناسبی برای استفاده به عنوان کاتالیست در کاتد هستند. همچنین میتوانند به عنوان محافظ در آند مورد استفاده قرار گیرند و کارایی الکترولیت را نیز بهبود بخشند.
۷-منابع
[1]P. Zhang, Y. Zhao, and X. Zhang, “Functional and stability orientation synthesis of materials and structures in aprotic Li–O2 batteries,” Chem. Soc. Rev., vol. 47, no. 8, pp. 2921–3004, 2018.
[2]C. Tran, X.-Q. Yang, and D. Qu, “Investigation of the gas-diffusion-electrode used as lithium/air cathode in non-aqueous electrolyte and the importance of carbon material porosity,” J. Power Sources, vol. 195, no. 7, pp. 2057–2063, 2010.
[3]J. Xiao et al., “Optimization of Air Electrode for Li / Air Batteries,” pp. 487–492, 2010.
[4] Lim, H. , Park, K. , Song, H. , Jang, E. Y., Gwon, H. , Kim, J. , Kim, Y. H., Lima, M. D., Robles, R. O., Lepró, X. , Baughman, R. H. and Kang, K. (2013), Enhanced Power and Rechargeability of a Li−O2 Battery Based on a Hierarchical‐Fibril CNT Electrode. Adv. Mater., 25: 1348-1352.
[5]E. Yoo and H. Zhou, “Li−Air Rechargeable Battery Based on Metal-free GrapheneNanosheet Catalysts,” ACS Nano, vol. 5, no. 4, pp. 3020–3026, Apr. 2011.
[6]J. Xiao et al., “Hierarchically Porous Graphene as a Lithium–Air Battery Electrode,” NanoLett., vol. 11, no. 11, pp. 5071–5078, Nov. 2011.
[7] Y. Li et al., “Nitrogen-doped carbon nanotubes as cathode for lithium–air batteries,” Electrochem. commun., vol. 13, no. 7, pp. 668–672, 2011.
[8] Y. Jing and Z. Zhou, “Computational Insights into Oxygen Reduction Reaction and Initial Li2O2 Nucleation on Pristine and N-Doped Graphene in Li–O2 Batteries,” ACS Catal., vol. 5, no. 7, pp. 4309–4317, Jul. 2015.
[9] J. Han et al., “Effect of Chemical Doping on Cathodic Performance of BicontinuousNanoporousGraphene for Li-O2 Batteries,” Adv. Energy Mater., vol. 6, no. 3, p. 1501870, Feb. 2016.
[10]Z. Peng, S. A. Freunberger, Y. Chen, and P. G. Bruce, “A Reversible and Higher-Rate Li-O2 Battery,” Science (80-. )., vol. 337, no. 6094, p. 563 LP-566, Aug. 2012.
[11]Y.-J. Kang, S. C. Jung, H.-J. Kim, Y.-K. Han, and S. H. Oh, “Maximum catalytic activity of Pt3M in Li-O2 batteries: M=group V transition metals,” Nano Energy, vol. 27, pp. 1–7, 2016.
[12]Y. J. Jun, S. H. Park, and S. I. Woo, “Combinatorial High-Throughput Optical Screening of High Performance Pd Alloy Cathode for Hybrid Li–Air Battery,” ACS Comb. Sci., vol. 16, no. 12, pp. 670–677, Dec. 2014.
[13]E. Yilmaz, C. Yogi, K. Yamanaka, T. Ohta, and H. R. Byon, “Promoting Formation of Noncrystalline Li2O2 in the Li–O2 Battery with RuO2 Nanoparticles,” NanoLett., vol. 13, no. 10, pp. 4679–4684, Oct. 2013.
[14]Z. Wang et al., “Cobalt nanoparticles encapsulated in carbon nanotube-grafted nitrogen and sulfur co-doped multichannel carbon fibers as efficient bifunctional oxygen electrocatalysts,” J. Mater. Chem. A, vol. 5, no. 10, pp. 4949–4961, 2017.
[15]R. Gao et al., “The role of oxygen vacancies in improving the performance of CoO as a bifunctional cathode catalyst for rechargeable Li–O2 batteries,” J. Mater. Chem. A, vol. 3, no. 34, pp. 17598–17605, 2015.
[16]W.-J. Kwak, K. C. Lau, C.-D. Shin, K. Amine, L. A. Curtiss, and Y.-K. Sun, “A Mo2C/Carbon Nanotube Composite Cathode for Lithium–Oxygen Batteries with High Energy Efficiency and Long Cycle Life,” ACS Nano, vol. 9, no. 4, pp. 4129–4137, Apr. 2015.
[17]Q.-C. Zhu et al., “A Composite of Carbon-Wrapped Mo2C Nanoparticle and Carbon Nanotube Formed Directly on Ni Foam as a High-Performance Binder-Free Cathode for Li-O2 Batteries,” Adv. Funct. Mater., vol. 26, no. 46, pp. 8514–8520, Dec. 2016.
[18]K. R. Yoon et al., “Brush-Like Cobalt Nitride Anchored Carbon Nanofiber Membrane: Current Collector-Catalyst Integrated Cathode for Long Cycle Li–O2 Batteries,” ACS Nano, vol. 12, no. 1, pp. 128–139, Jan. 2018.
[19]N. Togasaki, T. Momma, and T. Osaka, “Role of the solid electrolyte interphase on a Li metal anode in a dimethylsulfoxide-based electrolyte for a lithium–oxygen battery,” J. Power Sources, vol. 294, pp. 588–592, 2015.
[20]D. J. Lee et al., “Composite protective layer for Li metal anode in high-performance lithium–oxygen batteries,” Electrochem. commun., vol. 40, pp. 45–48, 2014.
[21]X. Zhang et al., “An Extremely Simple Method for Protecting Lithium Anodes in Li-O2 Batteries,” Angew. Chemie Int. Ed., vol. 57, no. 39, pp. 12814–12818, Sep. 2018.
[22] K. M. Abraham and Z. Jiang, “ELECTROCHEMICAL SCIENCE AND TECHNOLOGY A Polymer Electrolyte-Based Rechargeable lithium / Oxygen Battery,” vol. 143, no. 1, pp. 1–5, 1996.
[23]T. Laino and A. Curioni, “A New Piece in the Puzzle of Lithium/Air Batteries: Computational Study on the Chemical Stability of Propylene Carbonate in the Presence of Lithium Peroxide,” Chem. – A Eur. J., vol. 18, no. 12, pp. 3510–3520, Mar. 2012.
[24] D. Xu, Z. Wang, J. Xu, L. Zhang, and X. Zhang, “Novel DMSO-based electrolyte for high performance rechargeable Li–O2 batteries,” Chem. Commun., vol. 48, no. 55, pp. 6948–6950, 2012.
[25]H.-G. Jung, J. Hassoun, J.-B. Park, Y.-K. Sun, and B. Scrosati, “An improved high-performance lithium–air battery,” Nat. Chem., vol. 4, p. 579, Jun. 2012.
[26] F. Li, H. Kitaura, and H. Zhou, “The pursuit of rechargeable solid-state Li–air batteries,” Energy Environ. Sci., vol. 6, no. 8, pp. 2302–2311, 2013.
[27]B. J. Bergner, A. Schürmann, K. Peppler, A. Garsuch, and J. Janek, “TEMPO: A Mobile Catalyst for Rechargeable Li-O2 Batteries,” J. Am. Chem. Soc., vol. 136, no. 42, pp. 15054–15064, Oct. 2014.
[28]D. Kundu, R. Black, B. Adams, and L. F. Nazar, “A Highly Active Low Voltage Redox Mediator for Enhanced Rechargeability of Lithium–Oxygen Batteries,” ACS Cent. Sci., vol. 1, no. 9, pp. 510–515, Dec. 2015.
[29]X. Gao, Z. P. Jovanov, Y. Chen, L. R. Johnson, and P. G. Bruce, “Phenol-Catalyzed Discharge in the Aprotic Lithium-Oxygen Battery,” Angew. Chemie Int. Ed., vol. 56, no. 23, pp. 6539–6543, Jun. 2017.
۸- پاورقیها
[1]Nonaqueous (aprotic)
[2] Aqueous
[3] Hybrid
[4] Solid state
[5] Activated carbon
[6]Mesopoure
[7]three-dimensional (3D) graphene frameworks
[8]doping
[9] Sol-gel
[10]Oxygen vacancy
[11]Solid electrolyte interphase (SEI)
[12]Dip coating
[13]Solid-state electrolyte
[14]Redox mediators (RMs)