یکشنبه 05 بهمن 1399 کد خبر: 84

یکی از مبانی مهم در روشهای پایین به بالا برای سنتز و تولید نانومواد، مفاهیم هستهزایی و رشد هستند. برای مثال در روش احیا شیمیایی (و برخی روشهای دیگر) برای ساخت نانوذرات، سه مرحله فوقاشباع، هستهزایی و رشد اتفاق میافتد که کنترل آنها بر روی اندازه، شکل و توزیع اندازه نانوذرات نهایی تاثیرگذار است. در ادامه این سه مرحله بیان و بررسی شده است.
۲- فوق اشباع[۱]
اولین مرحله فوقاشباع است. برای فهم سادهتر فوقاشباع، یک لیوان آب گرم را فرض کنید که میخواهید به آن شکر اضافه کنید. همانطور که میدانید تنها تا مقدار مشخصی شکر میتواند در آن لیوان حل شود و اگر مقدار شکر اضافه شده خیلی زیاد شود، شکر تهنشین میشود. در واقع در همین مرحله فوق اشباع رخ داده است. همچنین به خوبی میدانید که افزایش دمای آب باعث انحلال مقادیر بیشتری از شکر در آن میشود. در سنتز نانومواد نیز این موارد صادق است. با حل مقادیر معین از پیشماده در حلال موردنظر میتوان فوقاشباع ایجاد نمود. برای اینکار میتوان دمای حلال را افزایش داد تا مقادیر بیشتری از پیشماده نیز در آن حل شود.
پس از فوقاشباع نوبت به هستهزایی میرسد. برای هستهزایی نیاز است تا محلول از حالت فوقاشباع خارج شود. خروج از حالت فوقاشباع به چند طریق میتواند صورت پذیرد. یکی از آنها افزایش غلظت پیشماده فراتر از غلظت فوقاشباع و دیگری کاهش دما پس از رسیدن به فوق اشباع هست. چراکه حلالیت در دمای پایینتر کمتر است و بدین وسیله با کاهش دما محلول از حالت فوقاشباع خارج میشود. روش دیگر، انجام واکنش شیمیایی در محلول و تولید فرآورده یا فرآوردههایی با حلپذیری کمتر است که در نتیجه آن نیز محلول از حالت فوق اشباع خارج شده و هستهزایی شروع میشود [۱].
|
تمرین یک مثال برای درک بهتر فوقاشباع، فرآیند ساخت نبات است. با جستجو در اینترنت در این باره مطالعه کنید. |
۳- هستهزایی
مرحله بعد هستهزایی است. همانطور که گفتیم، پس از رسیدن به فوقاشباع، در صورت کاهش دما، افزایش غلظت یا شکلگیری ترکیب جدید با حلپذیری کمتر، محلول از حالت فوقاشباع خارج میشود و هستهزایی شروع میشود. در واقع در صورت رخ دادن هرکدام از سه حالت بالا، محلول دیگر از لحاظ ترمودینامیکی تمایلی ندارد تا پیشماده را به صورت محلول در خود نگه دارد و تمایل دارد تا آن را به شکل جامد تبدیل کند. در اثر این تمایل، به مرور تعدادی هسته اولیه درون محلول شکل میگیرد. اصطلاحا به این هستههای اولیه جوانه گفته میشود. این جوانهها با توجه به شرایط محلول و اندازهشان، میتوانند رشد کنند و تبدیل به نانو ذره شوند و یا مجددا درون محلول حل گردند.
مرحله بعد از هستهزایی، رشد است. در این مرحله جوانهها رشد کرده و تبدیل به نانوذرات میشوند. این فرآیند در شکل۱ نمایش داده شده است [۲].
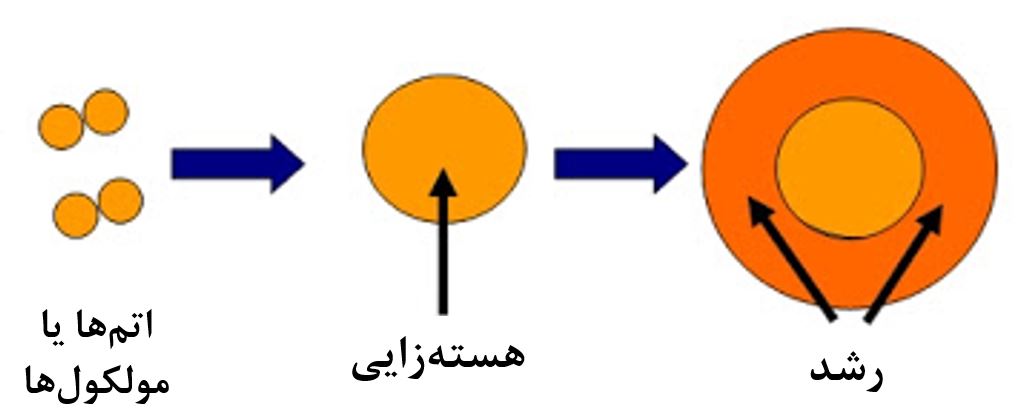
شکل۱- نمایش هستهزایی و رشد
۴- رشد
مرحله سوم پس از شکلگیری جوانهها، رشد است. در این مرحله اگر جوانههای ایجاد شده پایدار بمانند، سایر اتمها یا مولکولهای موجود در محلول به جوانهها ملحق میشوند و آنها را بزرگتر میکنند و نانوذرات را تشکیل میدهند. اگر رشد کنترل نشود و در جای موردنظر متوقف نگردد، ممکن است نانوذره به قدری بزرگ شود که دیگر ابعاد آن بزرگتر از ابعاد نانو شود و برای مثال یک میکروذره تولیدگردد. برای کنترل رشد از روشهای پایدارسازی نانومواد استفاده میشود.
در ادامه به معرفی هستهزایی و رشد به دو صورت همگن و غیرهمگن پرداخته و مبانی آنها را بر طبق تغییرات انرژی بررسی خواهیم کرد.
۵- هستهزایی و رشد همگن
منظور از هستهزایی و رشد همگن یا هموژن، انجام هستهزایی و رشد درون یک محلول بدون وجود سطح خارجی است. در صورتیکه سطح خارجی درون محلول وجود داشته باشد، گفته میشود که هستهزایی و رشد غیرهمگن یا هتروژن بوده است. هستهزایی و رشد غیرهمگن سریعتر و سادهتر اتفاق میافتد. برای فهم بهتر این موضوع میتوانید به فرآیند تولید نبات دقت کنید. تولید نبات مثال خوبی از تولید به روش غیرهمگن است. چراکه پس از ایجاد فوق اشباع، چوب نبات (یا نخ) وارد محلول میشود و نبات اطراف این چوب تشکیل میگردد. چوب نبات مصداق سطح خارجی در این فرآیند است و تشکیل نبات در صورت وجود این سطح خارجی سریعتر و راحتتر صورت میپذیرد (شکل۲).

شکل۲- تولید نبات به روش غیرهمگن
در سنتز و تولید نانومواد به روش همگن، هیچگونه سطح خارجی در محلول وجود ندارد. در این صورت باتوجه به تغییرات انرژی آزاد هستهزایی و رشد بررسی میشود. به این منظور به شکل۳ دقت کنید.
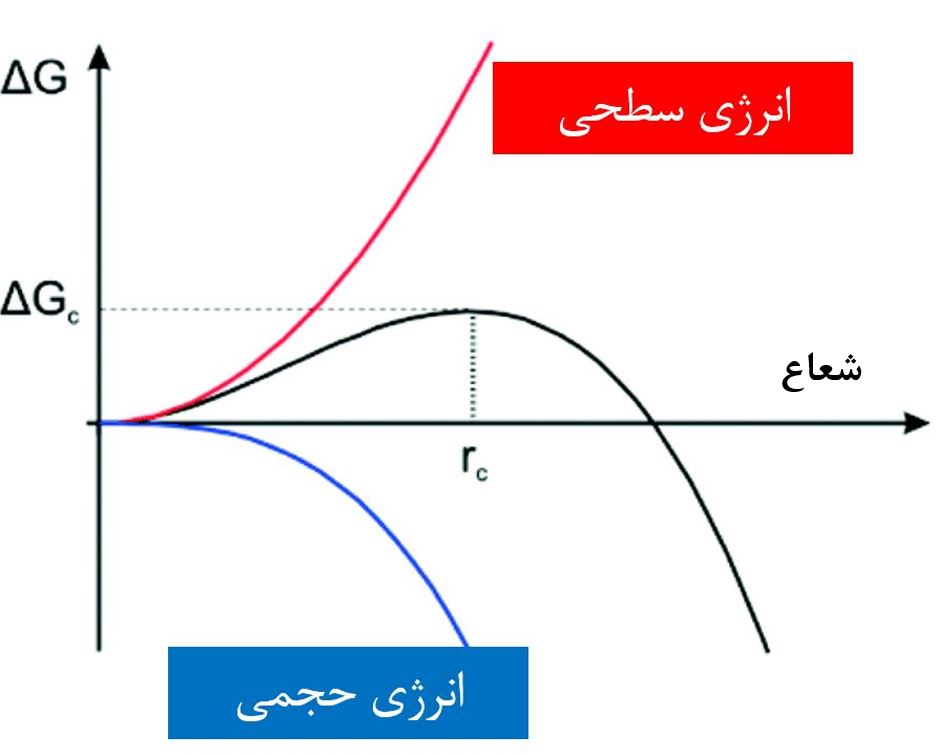
شکل۳- تغییرات انرژی آزاد باتوجه به شعاع هسته ایجاد شده[۲]
در شکل۳ تغییرات انرژی آزاد سطحی با رنگ قرمز، تغییرات انرژی آزاد حجمی با رنگ آبی و تغییرات انرژی آزاد کل (ناشی از برآیند انرژی سطحی و حجمی) با رنگ مشکی نمایش داده شده است. تمایل طبیعت کاهش انرژی آزاد است، درنتیجه افزایش شعاع هسته ایجاد شده در محلول از جهت انرژی سطحی غیر مطلوب و از نظر انرژی حجمی مطلوب است. منظور از غیرمطلوب بودن انرژی سطحی این است که با تشکیل هسته درون محلول، یک سطح بین محلول (مایع) و هسته (جامد) ایجاد میشود که سیستم به آن تمایلی ندارد و باعث افزایش انرژی آزاد آن میگردد. اما از طرف دیگر با افزایش شعاع هسته درون محلول، انرژی حجمی در حال کم شدن است. انرژی حجمی، انرژی آزادی است که در اثر افزایش حجم هسته کاهش مییابد.
در نتیجه مشاهده کردید که بزرگتر شدن هسته مورد تمایل سیستم نیست و حتی برای سیستم غیرمطلوب است. پس باید برآیند هر دو انرژیهای سطحی و حجمی را با هم حساب نمود. اگر اینکار انجام شود منحنی مشکی رنگ در شکل۳ رسم میشود.
مطابق منحنی مشکی رنگ مشاهده میشود که افزایش شعاع جوانه تا یک محدوده بحرانی (به نام شعاع بحرانی که با rc نمایش داده شده است) باعث افزایش انرژی آزاد شده و درنتیجه مورد تمایل سیستم نیست. ولی اگر شعاع جوانه بیشتر از شعاع بحرانی شود، بعد از آن بزرگتر شدن جوانه مورد تمایل سیستم است.
حال بیایید تا هستهزایی و رشد را طبق منحنی مشکی رنگ یکبار دیگر بررسی کنیم. پس از فوق اشباع و هستهزایی در محلول جوانههایی تشکیل میشود. اگر شعاع این جوانهها کمتر از شعاع بحرانی باشد، جوانهها مجددا در محلول حل شده و از بین میروند. ولی اگر شعاع آن بیشتر از شعاع بحرانی باشد، رشد میکنند و درنهایت به یک نانوذره تبدیل میشوند.
حال سوال دیگر اینجاست که چه اتفاقی میافتد تا جوانههایی با شعاع بیشتر از شعاع بحرانی ایجاد میشوند؟
این اتفاق زمانی میافتد که در اثر برخورد اتفاقی تعدادی جوانه ریز یا تعداد زیادی اتم/مولکول با هم جوانهای با شعاع بحرانی یا بیشتر از آن ایجاد شود. وگرنه ایجاد جوانهای با شعاع کمتر از شعاع بحرانی و رشد به مرور آن امکانپذیر نیست. برخورد اتفاقی نیز در اثر حرکت براونی ذرات و همانطور غلظت نسبتا زیاد در محلول اتفاق میافتد.
همچنین مورد دیگری که باید به آن توجه کنید تغییرات انرژی آزاد در شعاع بحرانی است. این میزان انرژی آزاد، میزان انرژیای است که سیستم نیاز دارد تا یک جوانه بحرانی تشکیل دهد. هرچه این میزان انرژی کمتر باشد، هستهزایی و سپس رشد راحتتر و سریعتر صورت میپذیرد [۱,۲].
۶- هستهزایی و رشد غیرهمگن
همانطور که گفته شد، در صورتیکه درون محلول سطح خارجی وجود داشته باشد، هستهزایی و رشد غیرهمگن است. این سطح خارجی معمولا یک جوانهزا است که به محلول اضافه شده است. قابل ذکر است که اکثرا نانومواد به این روش سنتز و تولید میشوند.
در شکل۴، ایجاد یک جوانه بر روی سطح خارجی نمایش داده شده است. منظور از شعاع برای این جوانه که به شکل نیمدایره است نیز نمایش داده شده است. قابل ذکر است که در روش همگن، جوانه ایجاد شده به شکل یک کره کامل است چراکه سطح خارجیای وجود ندارد.
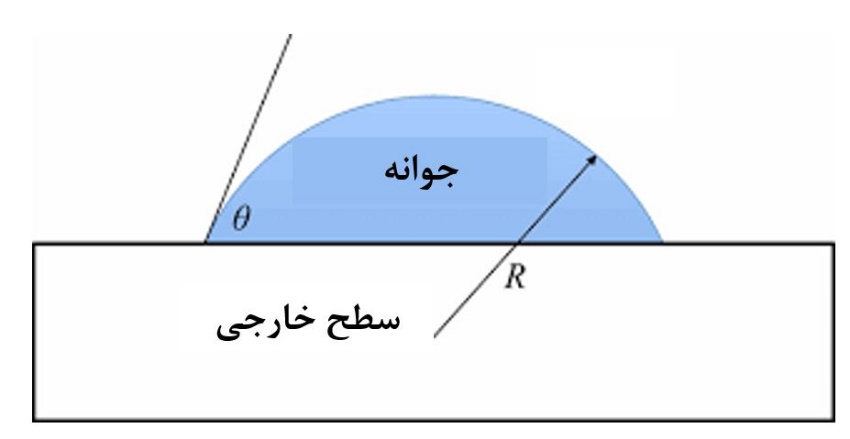
شکل۴- ایجاد جوانه بر روی سطح خارجی و شعاع آن[۲]
در شکل۵ مقایسهای بین نمودار انرژی آزاد در روش هستهزایی و رشد همگن (هموژن) و غیر همگن (هتروژن) نمایش داده شده است.
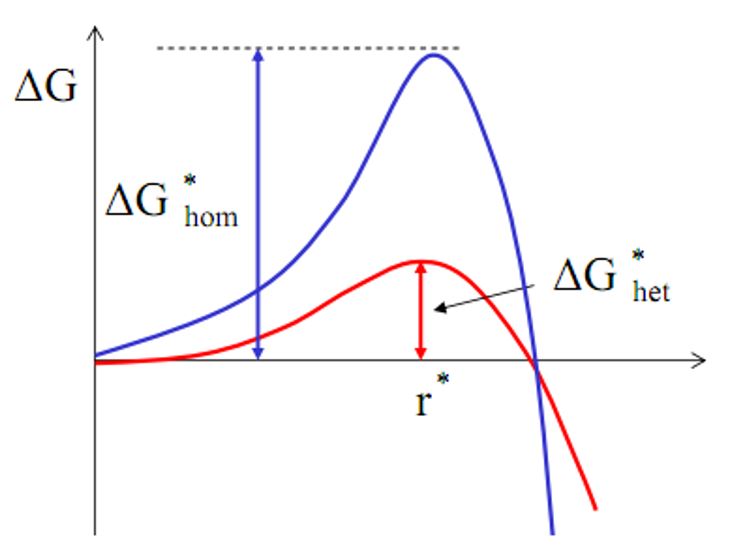
شکل۵- مقایسه بین انرژی آزاد در حالت همگن (آبی رنگ) و غیرهمگن (قرمز رنگ)[۱]
از شکل۵ دو نتیجه مهم میتوان گرفت. اولین نتیجه این است که انرژی آزاد موردنیاز برای شکلگیری جوانۀ بحرانی در حالت غیرهمگن کمتر از حالت همگن است (چراکه منحنی قرمزرنگ پایینتر از منحنی آبی رنگ است). درنتیجه این امر میتوان متوجه شد که در حالت غیرهمگن بسیار راحتتر و سریعتر جوانهها ایجاد و رشد میکنند.
نتیجه مهم دیگر نیز این است که شعاع بحرانی در حالت همگن و غیر همگن با هم تفاوتی نمیکنند و در دو حالت یکسان هستند. البته باید توجه نمود که در اینجا فرض بر این است که نوع ماده، حلال، دما و سایر شرایط محلول در دو حالت یکسان است. باتوجه به شکل۴ میتوان متوجه شد که علیرغم یکسان بودن شعاع بحرانی در دو حالت همگن و غیرهمگن، تعداد اتمهای کمتری در حالت غیرهمگن نیاز است تا جوانه به شعاع بحرانی برسد. چراکه در حالت همگن برای رسیدن به شعاع بحرانی نیاز به تشکیل یک کره کامل بود، ولی در حالت غیرهمگن با تشکیل بخشی از کره نیز میتوان به شعاع بحرانی رسید که این امر با تعداد اتمهای کمتر نیز به وقوع میپیوندد. درنتیجه مشاهده نمودید که هستهزایی و رشد در حالت غیرهمگن سادهتر و سریعتر است [۱,۲].
|
تمرین برای ایجاد نانوذراتی با اندازه یکنواخت چه کاری میتوان انجام داد؟ پاسخ: در صورتیکه شرایط به گونهای کنترل شود که ابتدا مرحله هستهزایی انجام شود و سپس با پایان این مرحله رشد شروع شود، توزیع اندازه نانوذرات باریک میشود و اندازه آنها یکنواخت میشود. قابل ذکر است که معمولا هستهزایی و رشد به صورت همزمان انجام میشود و به همین دلیل توزیع اندازه نانوذرات نهایی میتواند وسیع باشد ولی با جداسازی مرحله هستهزایی از مرحله رشد میتوان نانوذراتی با اندازه یکنواخت بدست آورد. |
|
تمرین افزایش سرعت هستهزایی چه تاثیری بر اندازه نانوذرات نهایی دارد؟ پاسخ: باعث ریزتر شدن نانوذرات نهایی میشود. افزایش سرعت هستهزایی به معنای ایجاد تعداد هستههای بیشتر در محلول است و ایجاد تعداد هستههای بیشتر باعث میشود تا رشد هرکدام از هستهها محدود شود و نانوذرات نهایی کوچکتر شوند. برای درک این موضوع باید توجه کنید که میزان پیشماده در محلول محدود است؛ حال اگر تعداد هستهها کم باشد تمام پیشمادهها به آن تعداد محدود هسته میپیوندند و باعث افزایش سایز آنها میشوند؛ ولی اگر تعداد هستهها زیاد باشد، پیشمادهها بین هستهها پخش میشوند و درنتیجه به هرکدام از هستهها پیشماده کمتری میرسد و کمتر رشد میکنند. |
۷- جمعبندی و نتیجهگیری
سه مرحله مهم در ساخت نانومواد در روشهای پایین به بالا عبارتند از فوقاشباع، هستهزایی و رشد. هستهزایی و رشد به دو حالت همگن و غیرهمگن میتواند انجام شود. در حالت غیرهمگن بر خلاف همگن، سطوح خارجی همچون جوانهزاها در محلول حضور دارند و به همین دلیل هستهزایی و رشد، سادهتر و سریعتر انجام میشود. از لحاظ شعاع بحرانی در هردو حالت همگن و غیرهمگن تفاوتی وجود ندارد ولی در حال غیرهمگن با استفاده از تعداد اتمهای کمتری میتوان به شعاع بحرانی برای رشد رسید. همچنین در حالت غیرهمگن انرژی آزاد موردنیاز برای رسیدن به شعاع بحرانی کمتر است.
۸- مراجع
[1].Guozhong, Cao. Nanostructures and nanomaterials: synthesis, properties and applications. World scientific, 2004.
[2]. Abbaschian, Reza, and Robert E. Reed-Hill. Physical metallurgy principles. Cengage Learning, 2008.
۹- پاورقی
[1] Supersaturation