دوشنبه 31 شهریور 1399 کد خبر: 8

۱-مقدمه
در علم بلورشناسی، حالتهای مختلف بلوری در مواد، قوانین حاکم بر آنها، آرایشهای اتمی یا مولکولی و نواقص بلوری، روشهای مشخصهیابی بلورها، خواص و ساخت بلورها و شبکه های بلوری مطالعه و بررسی میشود. در گذشته در بلورشناسی تمرکز بیشتر روی شکل بیرونی ساختارهای بلوری بود (مثلا در کانیشناسی)، ولی امروزه بررسیها بیشتر معطوف به ساختار داخلی بلورهاست. این تحول به ویژه پس از کشف پرتو ایکس توسط رونتگن در قرن ۱۹ رخ داد، چراکه دانشمندان میتوانستند به کمک آن اطلاعات ارزشمندی از ساختار داخلی بلورها بدست بیاورند. بهصورت کلی بلورشناسی را میتوان به عنوان شاخهای از علم که به توصیف هندسه و چینش اتمها در ساختار داخلی بلورها میپردازد، تعریف نمود. در حقیقت بلورشناسی یکی از حوزههای کلیدی برای درک خواص مختلف است و با دانستن آن میتوان دلیل ویژگیهای بسیاری از مواد را توضیح داد و ساختار مواد را قبل از تولید آنها تعیین نمود [۱,۲].
بهصورت کلی میتوان جامدات را باتوجه به نحوه قرارگیری واحدهای سازندهشان (این واحدها میتوانند اتمها، مولکولها و یا یونها باشند) در کنارهم، به دو دسته عمده تقسیم نمود. این دو دسته عبارتند از جامدات کریستالی و جامدات غیرکریستالی یا بیشکل. جامدات کریستالی دارای نظم بلندبرد (نظم در سه جهت فضایی در امتداد طولانی) میباشند در حالیکه جامدات بیشکل نظم کوتاهبرد دارند. این مورد در شکل ۱ نمایش داده شده است. همانطور که مشاهده میشود، اتمهای تشکیلدهنده در هر دو ساختاراکسیژن و سیلیسیوم هستند، اما وجود نظم با برد بلند و کوتاه در آنها باعث ایجاد ساختارهای مختلف با خواص متفاوتی شده است. منظور از نظم کوتاهبرد در شکل۱ این است که در تمام این ساختار اطراف اتم سیلیسیوم، ۴ اتم اکسیژن قرار گرفته است. به عبارت دیگر هر واحد SiO2 دارای نظم اتمی است اما در مقیاس بلند واحدهای SiO2 بهصورت منظم در کنار یکدیگر قرار نگرفتهاند. البته با توجه به اینکه شکل دو بعدی است سه اتم اکسیژن قابل مشاهده است و اتم چهارم در خارج از صفحه قرار دارد. با این وجود در شکل ۱ - ب نه تنها نظم اتمی در واحدهای SiO2 برقرار است بلکه واحدهای SiO2 در یک امتداد بسیار طولانی در سه جهت فضایی با ساختار شش ضلعی در کنار یکدیگر قرار گرفتهاند (نظم بلند دامنه).
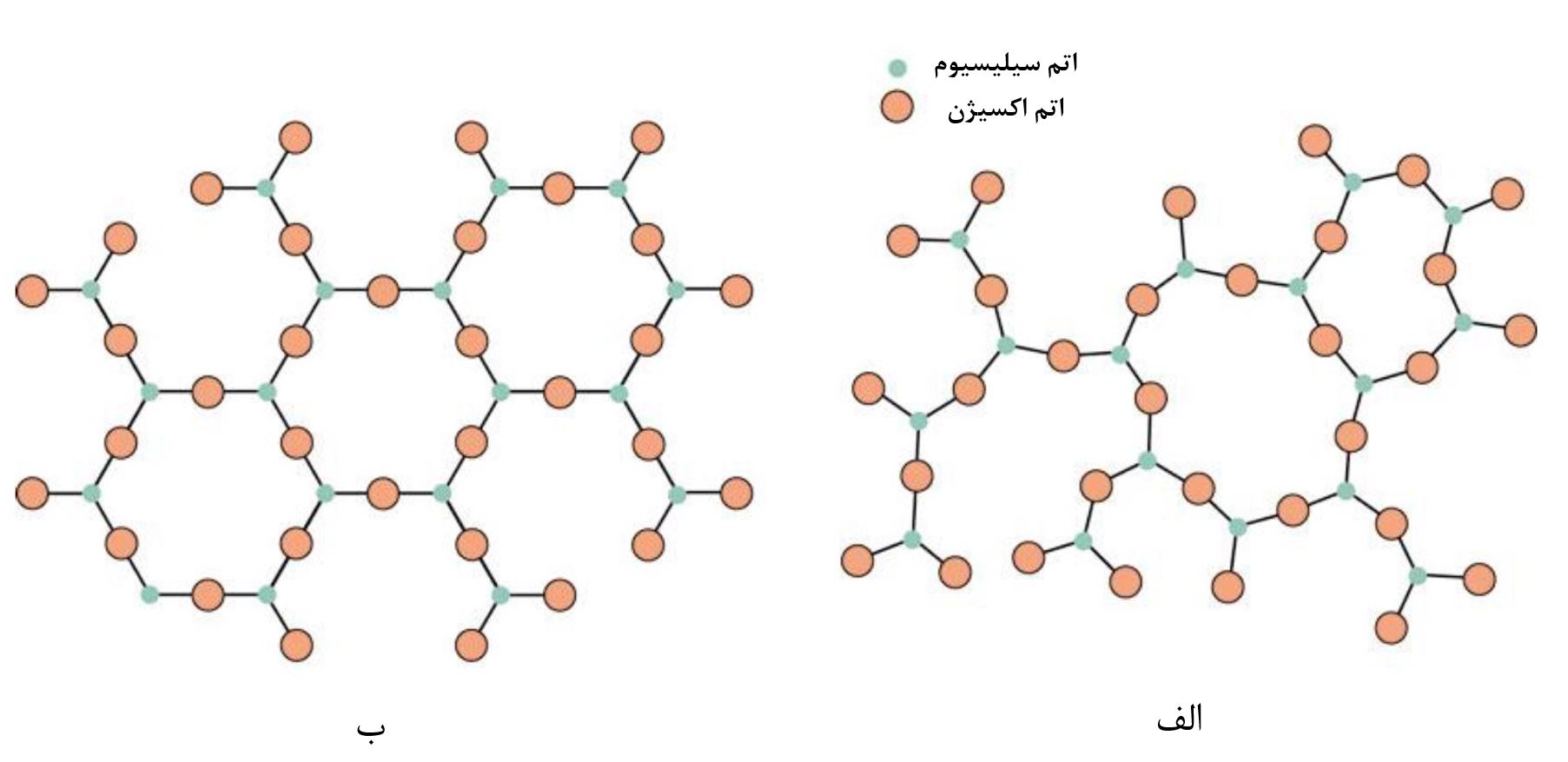
شکل۱- قرارگیری اتمهای سیلیسیوم و اکسیژن در کنار هم به شکل (الف) بیشکل با نظم کوتاه برد و (ب) بلوری با نظم بلند برد [۱]
قابل ذکر است که از لحاظ ترمودینامیکی مواد شیشهای (منظور موادی با ساختار بیشکل است)، شبه پایدار [1] هستند، یعنی اگر زمان و انرژی گرمایی کافی به آنها داده شود و بتوانند ساختار خود را بازچینش کنند و ساختار بلوری بیابند، سطح انرژی پایینتری را خواهند داشت. همانطور که میدانید از لحاظ ترمودینامیکی همه مواد در طبیعت تمایل دارند که سطح انرژی کمتری را داشته باشند و زمان و انرژی، امکان کاهش سطح انرژی مواد را مشخص میکند. در شکل۲ مقایسه سطح انرژی بین حالت کریستالی و بیشکل آورده شده است. مطابق این شکل مشاهده میشود که حالت بلوری سطح انرژی پایینتری نسبت به حالت بی شکل دارا میباشد [۱,۳].
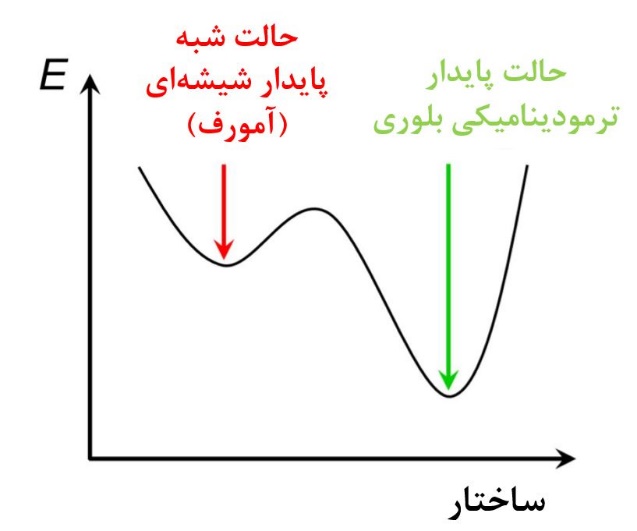
شکل۲- مقایسه انرژی در حالت بیشکل و بلوری [۳]
حال که مشاهده میشود ساختار بلوری سطح انرژی کمتری از بیشکل دارد پس دلیل شکلگیری ساختارهای بیشکل چیست؟ یکی از دلایل این است که ساختار مواد تشکیلدهنده ماده پیچیده هستند (از جهت تعداد و تفاوت اندازه) و به سادگی نمیتوانند با نظمی سهبعدی و بلندبرد در کنار یکدیگر قرارگرفته و ساختار بلوری را تشکیل دهند. دلیل دیگر این است که ممکن است ساختار جامد به سرعت شکل بگیرد (مثلا یک مذاب فلزی سریع جامد شود) و اتمها یا مولکولها فرصت کافی را پیدا نکنند تا در یک ساختار بلندبرد بلوری در کنار یکدیگر قرار بگیرند [۳].
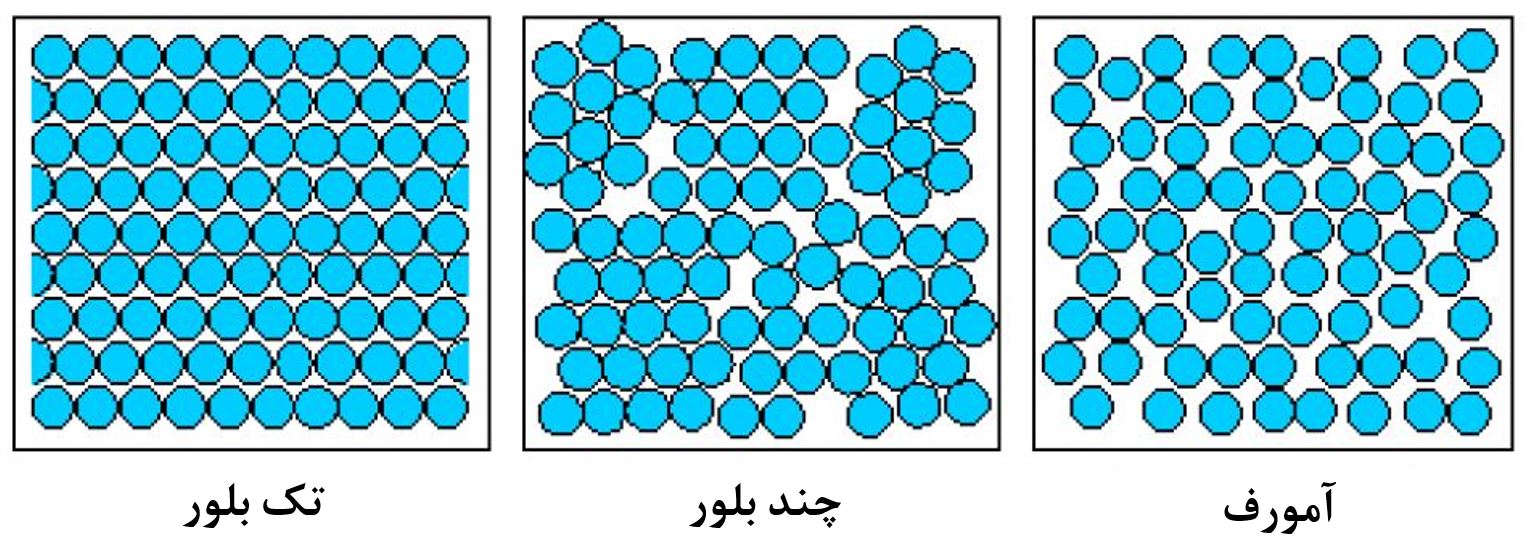
شکل۳- طرحی از ساختارهای جامد تک بلور، چند بلور و بیشکل [۲]
قابل ذکر است که خود مواد بلوری نیز به دو دسته تقسیم میشوند که عبارتند از مواد تکبلور [۲]و چندبلور[۳]. در شکل ۳ طرحی از ساختارهای جامد تک بلور، چند بلور و بیشکل نشان داده شده است.
آرایش اتمها در مواد تکبلور بهطور منظم، متناوب و تکرارشونده در سراسر یک جامد بلوری است. اما مواد چندبلور دارای تعداد زیادی از بلورهای ریز (به آنها دانه گفته میشود) هستند. در هر یک از این دانهها میتوانند جهتهای بلوری متفاوتی نسبت به دانههای دیگر داشته باشند. در نتیجه، یک جامد چندبلور دارای دانههای بلوری است که با یکدیگر در جهت بلوریشان تفاوت دارند. برای فهم بهتر این موضوع، بهتر است فرآیند انجماد یک مذاب فلزی را بررسی کنیم.
در حین انجماد یک مذاب فلزی، به مرور با کاهش دما، بلورهای جامد کوچکی که به آنها هسته میگوییم، در نقاط مختلف مذاب تشکیل میشوند که دارای یک نظم بلند برد هستند، ولی اندازه بسیار کوچکی دارند (شکل۴-الف). با گذشت زمان و کاهش تدریجی دما، به مرور اتمهای بیشتری از مذاب به هستههای ایجاد شده میپیوندند و باعث رشد آنها در جهتهای بلوری مختلفی میشوند (شکل۴-ب). در نهایت با انجماد کامل مذاب، ساختار چندبلوری به دست میآید که در آنها تفاوت جهت بلوری از دانهای به دانه دیگر وجود دارد (شکل۴-ج). به مرز بین این دانهها که در واقع محل رسیدن دو دانه با جهتهای بلوری متفاوت هستند، مرزدانه گفته میشود. در شکل ۴-د مرزدانهها نمایش داده شده است. همچنین در شکل4-ه تصویری واقعی از مرزدانهها در یک فلز که توسط میکروسکوپ نوری گرفته شده است، مشاهده میشود [۴].

شکل۴- فرآیند انجماد یک مذاب فلزی و تشکیل جامد چندبلور. الف) تشکیل هسته ب) رشد هسته ج) تکمیل رشد و انجماد کامل د) نمایش مرزدانهها به صورت شماتیک ه) تصویر میکروسکوپ نوری از دانهها و مرزدانهها [۲]
در مقالات بعدی بیشتر درباره دانهها و مرزدانهها صحبت خواهد شد، چرا که اهمیت فراوانی در خواص و ویژگیهای مواد بلوری دارند.
دو مفهوم مهم در بلورشناسی وجود دارد که عبارتند از سلول واحد [۴]و شبکه[۵]/ پایه [۶]. نکته اساسی در تعریف سلول واحد و شبکه/ پایه این است که اتمها به صورت کرههایی صلب فرض میشوند. درنتیجه مواردی همچون همپوشانی اتمها درنظر گرفته نمیشوند و اتمها مانند تیلههایی کروی و صلب درنظرگرفته میشوند.
منظور از شبکه چینشی از نقاط در فضاست که یک مفهوم کاملا ریاضی است و منظور از پایه واحدهای ساختاری تکرارشوندهای هستند که میتوانند نقاط شبکه را اشغال کنند.
به عبارت دیگر، ساختار بلوری عبارت است از شبکهای که توسط پایهها اشغال شده است. برای فهم بهتر این موضوع به شکل ۵ و ۶ توجه کنید. همانطور که میبینید شبکه در واقع چینشی از نقاط است که توسط پایههای مختلفی میتواند پر شود و با توجه به اینکه شبکه و پایه به چه صورت باشند، ساختارهای بلوری مختلفی میتواند شکل بگیرد [۴].
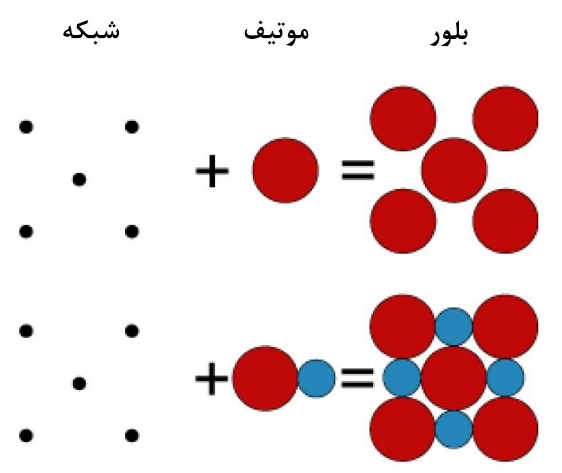
شکل۵- طرحی دوبعدی از تشکیل بلور حاصل از قرارگیری پایههای گوناگون در شبکه [۴]
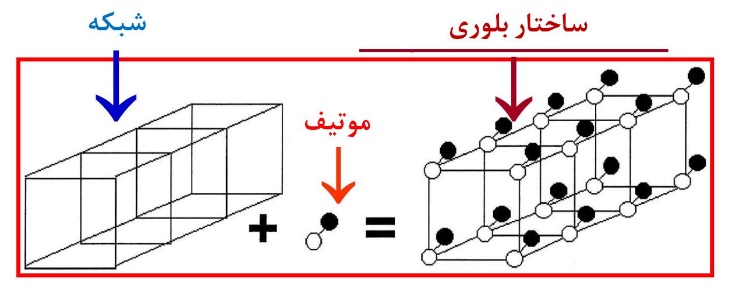
شکل۶- طرحی سه بعدی از تشکیل بلور حاصل از قرارگیری پایه در شبکه [۴]
همانطور که در شکل۵ مشاهده میشود، پایه میتواند اتم یا گروهی از اتمها باشد که در جایگاه شبکه قرار میگیرند. در واقع شبکه به ما میگوید که تکرار آرایهها به چه صورت است، ولی پایه به ما میگوید که این آرایهها چه هستند.
سلول واحد، کوچکترین واحد تکرارشونده در بلور است که با تکرار آن در سهبعد میتوان شبکه بلوری را به وجود آورد. به عبارت دیگر سلول واحد کوچکترین ابعاد نظم اتمی در ماده را به نمایش میگذارد. درحقیقت، سلول واحد نماینده یک شبکه بلوری است، چرا که با دانستن آن میتوان تمام ویژگیهای هندسی بلور را دانست. برای مثال در شکل ۷ سلول واحد یک ساختار بلوری نمایش داده شده است. همانطور که میبینید برای ساخت این ساختار بلوری میتوان سلول واحد مشخص شده را در سه بعد تعمیم داد تا ساختار بلوری شکل۷ شکل بگیرد.
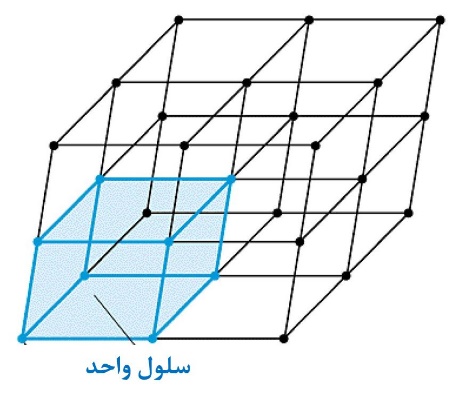
شکل۷- سلول واحد در یک ساختار بلوری
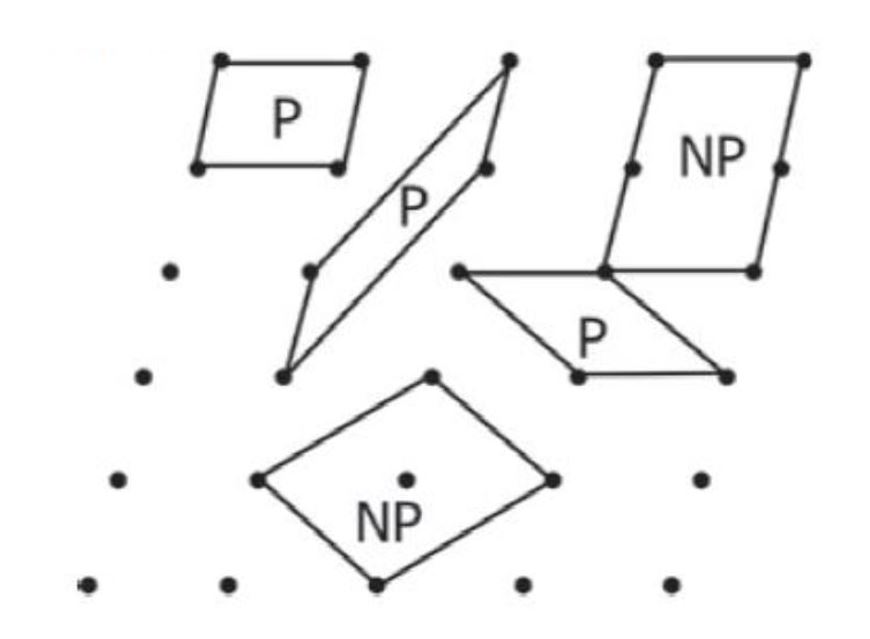
برای انتخاب سلول واحد یک ساختار بلوری باید به چند نکته دقت کرد:
سلول واحد انتخابی در شکل۷ دارای تمام این ویژگیها است. منظور از اینکه دارای یک نقطه شبکه باشد را با مثالی نشان میدهیم. فرض کنید شکل۷ نمایش ساختار بلوری یک فلز باشد، هر کدام از نقاطی که در این شکل نشان داده شده نشانگر یکی از اتمهای آن فلز میباشد و هر اتم فلز نیز به هشت سلول واحد که در مجاورت یکدیگر قرار دارند تعلق دارد، (برای تصور این موضوع اتمی که در مرکز شکل ۷ است را در نظر بگیرید، این اتم به ۴ سلول واحد موجود در صفحه پایینی و ۴ سلول واحد موجود در صفحه بالایی تعلق دارد). با توجه به اینکه هر اتم در هشت سلول واحد قرار دارد میتوان گفت که یک هشتم هر اتم به صورت خالص متعلق به یک سلول واحد است. از آنجا که سلول واحد نمایش داده شده دارای هشت اتم است (که یک هشتم هر کدام از آنها متعلق به آن سلول واحد است) پس داریم: و در نتیجه یک اتم به صورت خالص متعلق به سلول واحد است که همان معنای شرط چهارم در بالا است [۳,۴].
برای مشخص کردن یک سلول واحد از ۶ پارامتر استفاده میشود (شکل۸). در این میان a، b و c طول اضلاع در راستای محورهای x، y و z بوده و α، β و γ به ترتیب زوایای مقابل محورهای x، y و z هستند. با داشتن این ۶ پارامتر میتوان ساختار بلوریهای مختلف را از هم متمایز نمود و هر کدام را باتوجه به سلول واحدش نشان داد.
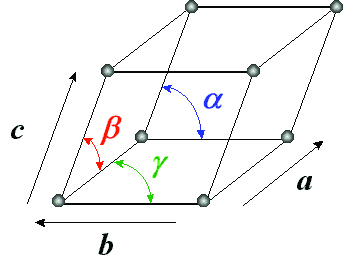
شکل۸- نمایش یک سلول واحد با ۶ پارامتر [۴]
با بررسی ساختار بلوری یک ماده و تعیین آن میتوان دلیل بسیاری از خواص و ویژگیهای آن را مشخص نمود. برای این منظور از علم بلورشناسی استفاده میشود تا با بررسی حالتهای مختلف بلوری در مواد، قوانین حاکم بر آنها، آرایشهای اتمی یا مولکولی، روشهای مشخصهیابی بلورها و ساخت بلورها اطلاعات ارزشمندی از ویژگیهای ماده به دست آورد. کسب اطلاعات از ساختار درونی بلورها در قرن نوزدهم با کشف پرتوایکس قوت گرفت و دوره جدیدی را در بلورشناسی ایجاد نمود. بسته به اینکه مواد دارای ساختار بیشکل باشند یا بلوری، خواص کاملا متفاوتی از خود نشان میدهند. یک ماده بلوری در حالت تکبلور یا چندبلور ویژگیهای متمایزی دارد که تمامی آنها تعیینکننده ساختار بلوری در یک ماده میباشند. برای نشان دادن ساختار بلوری یک ماده میتوان سلول واحد را به نمایندگی از آن ساختار بلوری نمایش داد. سلول واحد دارای ۶ پارامتر (اندازه اضلاع و زاویه بین آنها) است که باعث یکتایی آنها میشود. همچنین انتخاب یک سلول واحد نیازمند دارا بودن شرایطی همچون ساده بودن، کوچک بودن، داشتن بیشترین تقارن و اولیه بودن آن سلول واحد است.
۵- مراجع
[1].Callister, William D., and David G. Rethwisch. Materials science and engineering: an introduction. Vol. 7. New York: John wiley & sons, 2007.
[2]. Allen, Samuel M., and Edwin L. Thomas. The structure of materials. Vol. 44. New York: Wiley, 1999.
[3]. Askeland, Donald R., and Pradeep P. Phule. The science and engineering of materials. Pacific Grove/Ca: Brooks/Cole, 2003.
[4]. De Graef, Marc, and Michael E. McHenry. Structure of materials: an introduction to crystallography, diffraction and symmetry. Cambridge University Press, 2012.
۶ - پاورقیها
[1]Metastable
[2]Single crystal
[3] Poly crystal
[4]Unit cell
[5]Lattice
[6] Motif
[7]Primitive