شنبه 27 دی 1399 کد خبر: 82

۱- مقدمه
روشهای هدفگیری و درمان سرطان در دو دسته طبقهبندی میشوند: ۱) پیامرسانی و ۲) تحویل هدفمند دارو. داروهای شیمیدرمانی معمول با هدفگیری و مهار مسیرهای پیامرسانی مورد نیاز جهت رشد، بقا و تقسیم سلولی عمل میکنند و با القای مرگ سلولی برنامهریزی شده(آپوپتوز[۱])، سلولهای مورد نظر را از بین میبرند. از آنجایی که این روش برای عمل بر روی سلولهای سرطانی اختصاصی نشده است، فرآیندهای سلولی، مولکولی و حیاتی بسیاری از سلولهای سالم مجاور نیز تحت تاثیر داروهای بسیار سمی شیمیدرمانی، دچار مشکل میشود.
سازوکارهای هدفگیری و تحویل دارو، از جدیدترین رویکردهای درمان سرطان است و به میزان زیادی برای سلولهای توموری اختصاص یافته است. تحویل هدفمند دارو، بازدهی درمان سرطان را بهبود میبخشد و تا حد زیادی عوارض جانبی داروهای ضدسرطان را کاهش میدهد. ترکیب ذرات، لیگاندها و سازوکارهای درمان سرطان برای طراحی یک کمپلکس دارو-نانوذره برای رسانش هدفمند دارو ضروری است[۱]. هدفگیری تومور با کمک نانوذرات با استفاده از دو روش صورت میگیرد:
۱) هدفگیری غیرفعال که منطبق با خصوصیات ویژۀ ریزمحیط پیرامون بافت سرطانیشده، موسوم به اصل «افزایش نفوذپذیری و نگهداری» انجام میشود. طراحی سامانههای دارویی بر این اساس، منجر به تجمع غیرفعال نانوذرات در اطراف سلولهای سرطانی میشود.
۲) هدفگیری فعال با استفاده از نانوحاملهای متصل به لیگاندهای اختصاصی گیرندههای سطح سلولهای سرطانی و به کارگیری عوامل فیزیکی خارجی مثل میدان مغناطیسی انجام میشود[۲]. در شکل (۱) تصویری از هدفگیری فعال و غیرفعال به بافت تومور نمایش داده شدهاست. در این مقاله درمورد ویژگیهای پاتوفیزیولوژیک ریزمحیط بافت سرطان و مهمترین روشهای غیرفعال رسانش دارو به آن بررسی میشود.
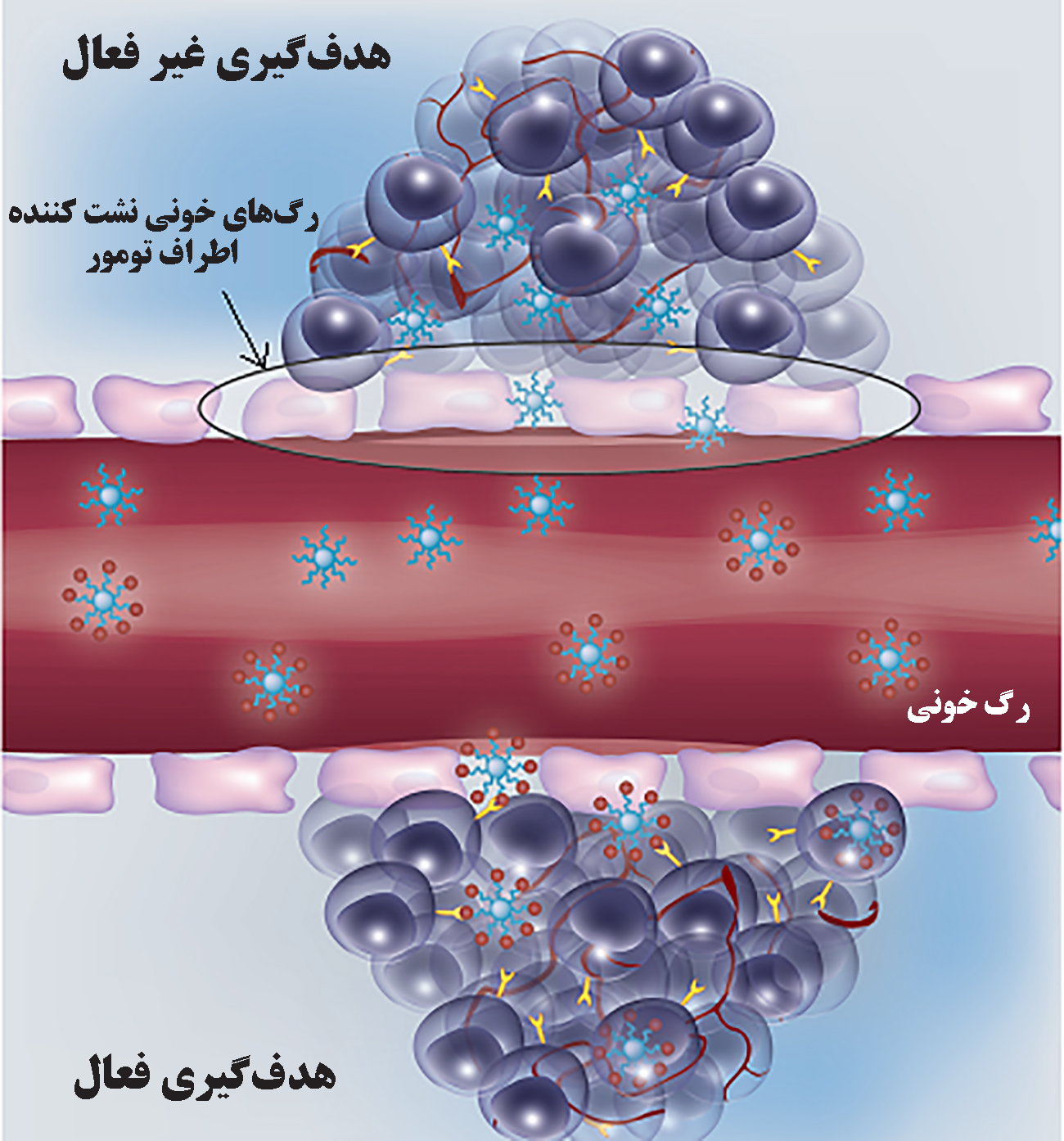
شکل ۱- تصویر هدفگیری فعال و غیر فعال به بافت تومور[۳]
|
کادر آموزشی سرخرگهای کوچک در انشعابات ریز شبکههای عروقی، به مویرگهایی منتهی میشوند که کوچکترین رگهای بدن هستند. دیوارهی مویرگها بسیار نازک و متشکل از یک لایه سلولهای پهن به نام اندوتلیال است که بر روی غشای پایه قرار گرفتهاند. انواع مختلف مویرگها با توجه به میزان اتصالات بین سلولی در سه گروه مویرگ پیوسته، منفذدار و غیرپیوسته تقسیم میشوند[۴]، که در شکل (۲) این سه گروه نمایش داده شدهاند. |
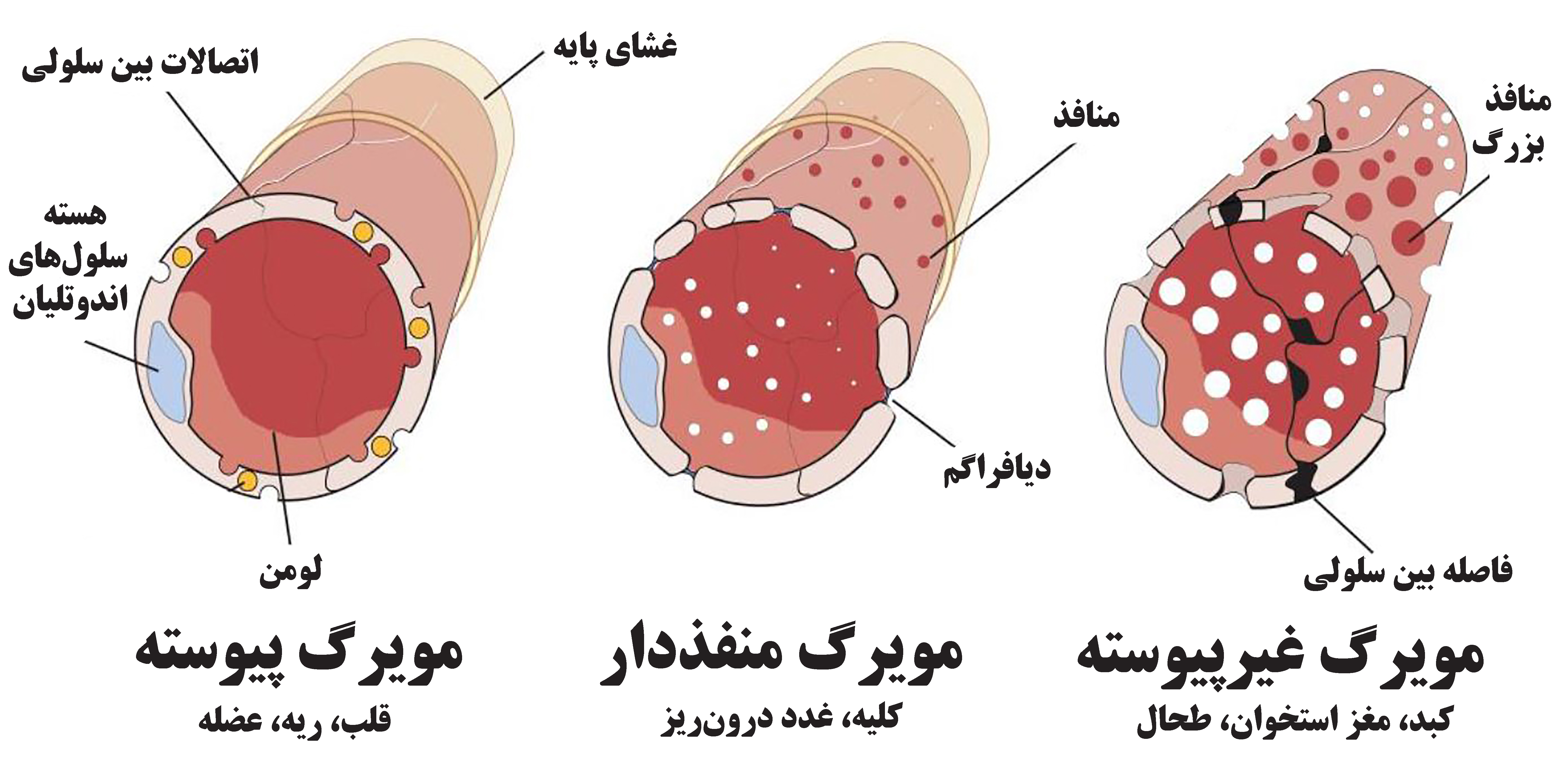
شکل ۲- تنوع و ساختار لایهبندی دیوارهی مویرگها[۴]
۲- هدفگیری غیر فعال
درمان هدفمند سرطان به منظور رسانش مستقیم دوز بالا از یک داروی ضدسرطان به محل سلولهای سرطان، افزایش جذب دارو در سلولهای سرطان و کاهش جذب دارو توسط سلولهای غیرسرطانی صورت میگیرد. بافت تومور، درمقایسه با بافتهای طبیعی دارای یک ریزمحیط خاص و متفاوت از لحاظ ساختار عروقی، اکسیژنرسانی، pH و فعالیتهای متابولیکی است. هنگامی که سلولهای سرطانی با سرعت بیشتری نسبت به بافتهای طبیعی رشد میکنند و به اندازۀ مشخصی در حدود ۲-۳ میلیمترمکعب میرسند، نیاز شدید به اکسیژن و موادغذایی و و درنهایت فرآیند آنژیوژنز[۲] (رگزایی) را آغاز میکنند. علاوهبر آن، وضعیت هیپوکسیک[۳] (کمبود اکسیژن و مواد غذایی) سلولهای سرطانی باعث تحریک گلیکولیز[۴] (فرآیند بیوشیمیایی شکست گلوکز در شرایط بدون اکسیژن) برای تامین انرژی بیشتر میشوند. تولید متابولیتهای اسیدی حاصل از گلیکولیز مثل اسیدلاکتیک، pH بافت تومور را به مقداری کمی تا pH=۶-۷، نسبت به pH بافت سالم که معادل ۷/۴ است، کاهش میدهد. در نظر گرفتن این شرایط با استفاده از نانوذرات سولفانامید حساس به pH، نتایج خوبی در جهت افزایش رهاسازی دارو و تعامل با سلولها در pH اسیدی ریزمحیط تومورها نشان داده است[۵]. با این حال زیست شناسی پیچیدۀ سلولهای سرطانی، موانع زیستی مختلفی برای رسانش دارو ایجاد میکند. برای مثال وقتی یک داروی ضدسرطان وارد جریان خون میشود، پروتئینهای خون به نام اپسونین[۵]، روی سطح دارو را میپوشانند و آن را به عنوان یک عامل خارجی جهت فرآیند فاگوسیتوز[۶] (ذرهخواری) به اجزای سلولهای ایمنی معرفی کرده و از رهایش دارو در بافت تومور جلوگیری میکنند. یکی از مزایای استفاده از نانوحاملها در دارورسانی، امکان پوشش سطحی با پلی اتیلن گلیکول(PEG) است. اصلاح سطحی با PEG، زیست سازگاری[۱] و مدت زمان گردش نانوساختارهای حامل دارو در خون را افزایش میدهد و با ممانعت از جذب پروتئینهای پلاسمایی، به عنوان نانوحاملهای مخفی[۷] در برابر سیستم ایمنی محافظت میکند[۵]. در شکل ۳، موانع سلولی، میکروسکوپی و ماکروسکوپی در دارورسانی به سلولهای سرطان نمایش داده شده است. بنابراین به طور کلی، در نظر گرفتن ویژگیهای فیزیولوژیکی منحصر به فرد بافت مورد نظر در طراحی سامانههای دارویی هدفمند، از روشهای هدفگیری غیرفعال است. با استفاده از این روش، تجمع انتخابی دارو در بدن با کنترل خصوصیات فیزیکوشیمیایی سامانهها به طوریکه با شرایط ریزمحیط بافت هدف منطبق باشد، صورت میگیرد[۶].
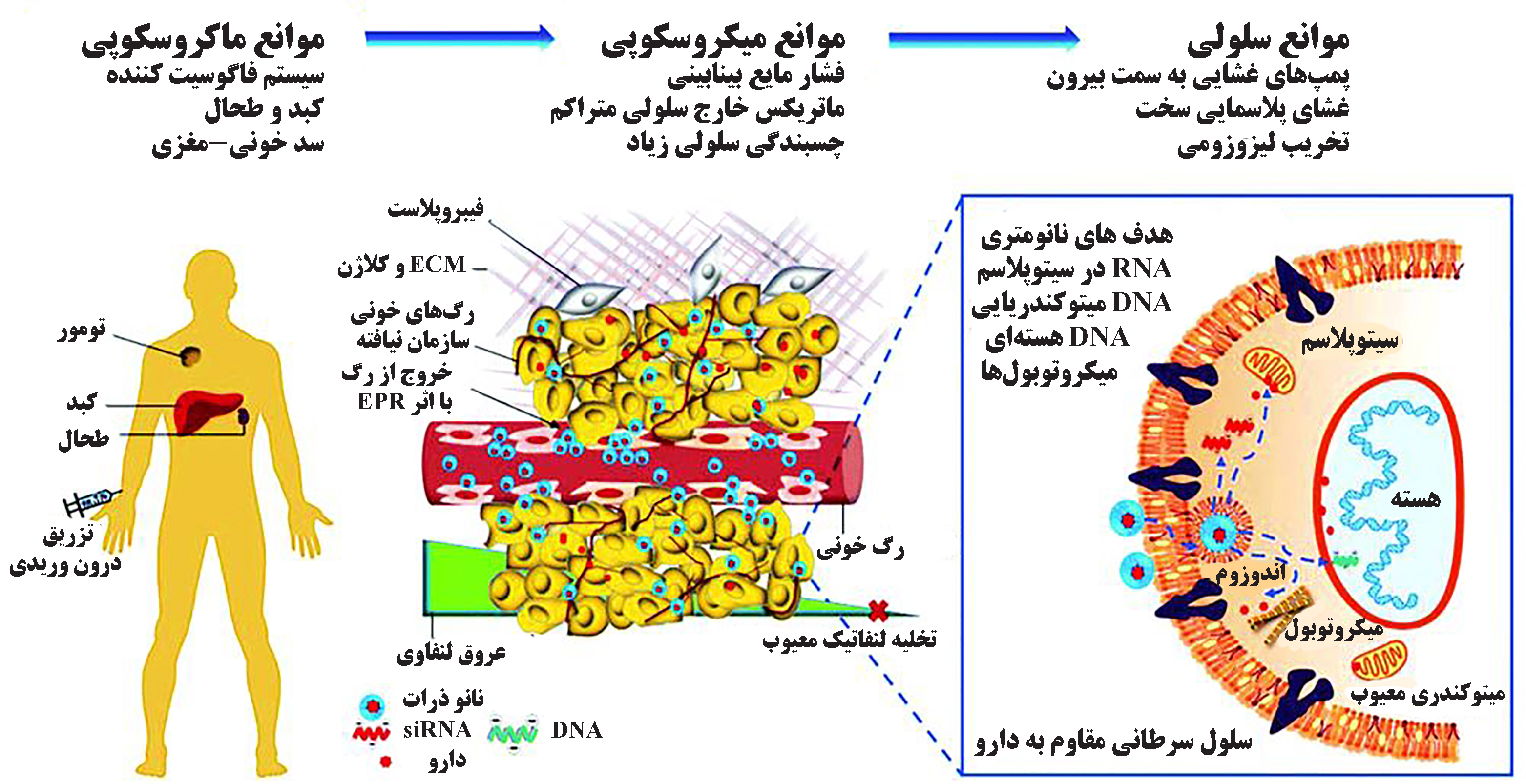
شکل ۳- موانع رسانش دارو در اطراف سلولهای سرطانی[۶]
برای مثال تاکنون مشخص شده است که تامین اکسیژن و موادغذایی از گردش خون متناسب با سرعت بالای رشد و تقسیم سلولهای سرطانی نیست؛ علاوهبر آن، به دلیل عدم تناسب سیستمهای پیامرسانی جهت رشد و به وجود آمدن رگهای جدید و با افزایش سرعت رگزایی، چینش سلولهای اندوتلیال نامنظمتر و اتصالات بین سلولی سستتر شده و رگهای نشتکننده با منافذ ۱۰۰ تا ۱۲۰۰ نانومتر بسته به نوع تومور شکل میگیرد[۷]. همچنین، الگوی رشد سلولهای سرطانی در اطراف عروق توموری نامنظم است یعنی سلولهایی که در نزدیکی رگهای خونی قرار دارند، با دریافت اکسیژن و مواد غذایی، سریعتر از سلولهای مرکز تومور رشد میکنند (شکل۴). بنابراین تحت شرایط خاصی مثل التهاب و هیپوکسی که در اطراف سلولهای سرطانی به طور معمول وجود دارد، لایۀ سلولهای اندوتلیال رگهای خونی تومور، نفوذپذیری بیشتری نسبت به رگهای خونی اطراف سلولهای سالم دارد و به طور انتخابی، ورود نانوسامانهها و ماکرومولکولهای بزرگتر از ۴۰ کیلودالتون از گردش خون به سمت بافت سرطانی افزایش مییابد. از طرف دیگر عدم تخلیه لنفاتیک طبیعی، باعث افزایش نگهداری نانوذرات در بافت سرطانی میشود[۸]. این دو ویژگی مهم بافت توموری، اثر «افزایش نفوذپذیری و نگهداری» موسوم به [۸] است و به عنوان یک استاندارد طلایی برای طراحی نانوسامانههای دارورسانی در روش غیرفعال در نظر گرفته میشود. اصل EPR باعث تجمع نانوحامل و داروهای کپسوله در بافت هدف براساس ویژگیهای فیزیکوشیمایی ریزمحیط اطراف سلولهای سرطانی مانند اختلاف دما، pH، ترکیبات شیمیایی و اندازۀ منافذ لایۀ اندوتلیال عروق میشود[۱].
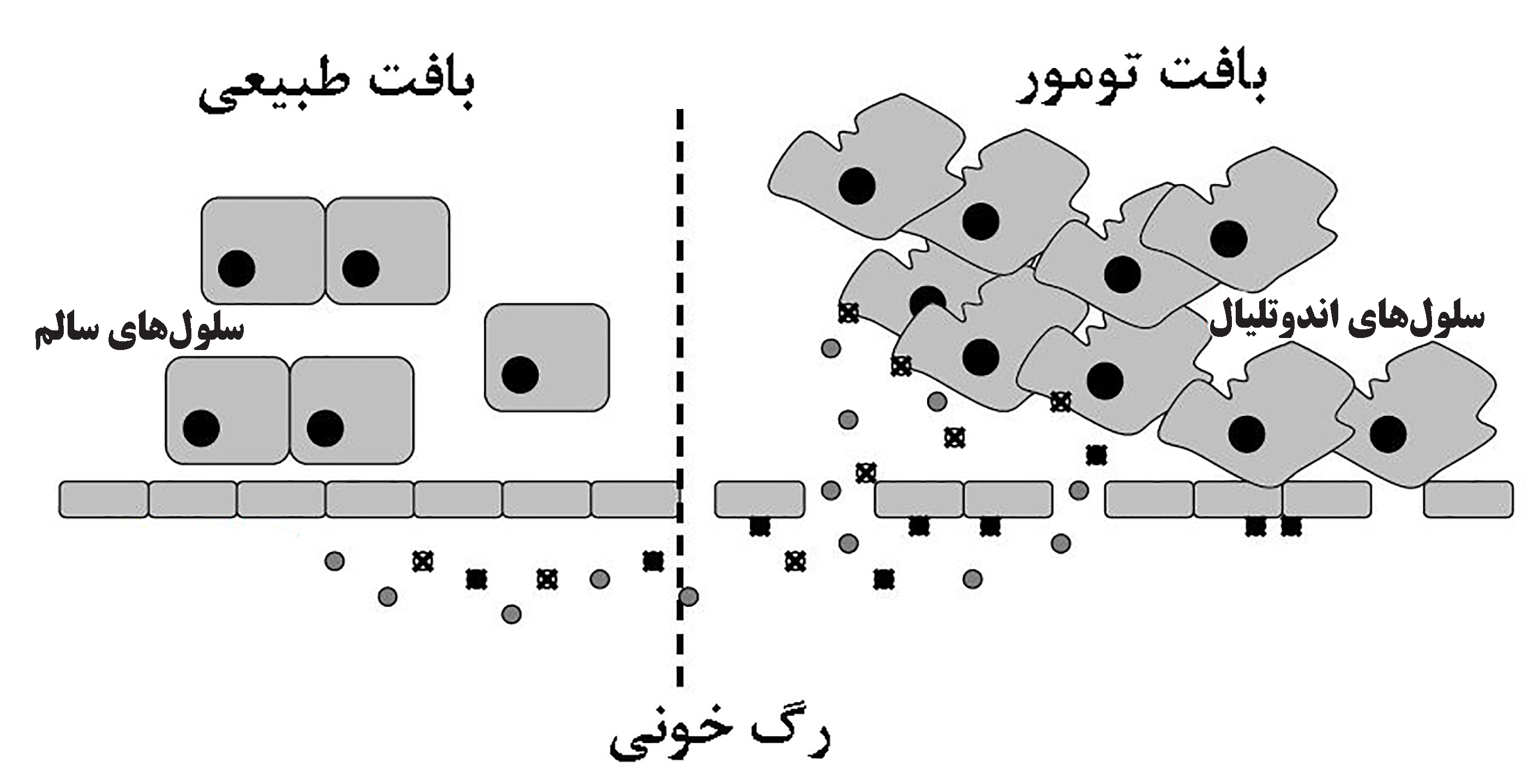
شکل ۴- از بین رفتن یکپارچگی دیواره عروق خونی در اطراف سلول های سرطانی[۸].
اثر EPR تا حد زیادی به زیست شناسی ذاتی تومور مانند: ۱) درجه رگزایی و لنفزایی، ۲) درجۀ رشد تومور در اطراف عروق و ۳) فشار داخل توموری بستگی دارد[۸]. با توجه به نشتی عروق و عدم عملکرد سیستم لنفاوی، فشار مایع بینابینی در مرکز تومور نسبت به حاشیه، بالا است و نفوذ و انتشار دارو به درون تومور محدود میشود. از طرف دیگر، نفوذپذیری عروق در قسمتهای مختلف یک بافت توموری و بین انواع تومورها مختلف است. برای مثال، تومورهای پانکراس و پروستات، برخلاف سایر بافتهای سرطانی درجۀ رگزایی بسیار کمی دارند[۵]. مجموعۀ این عوامل به همراه خصوصیات فیزیکوشیمیایی نانوحاملها، بازدهی دارورسانی را تعیین میکنند[۸]. بنابراین پیش از طراحی یک سیستم دارویی برای رسانش غیرفعال، ماهیت تومور باید به خوبی شناخته شود[۵].
روشهای دیگری برای هدفگیری غیرفعال وجود داردکه عبارتند از: ۱) هدفگیری غیرفعال آنزیمی (در اثر تبدیل فرم غیرفعال دارو به فرم فعال در اثر حضور یک آنزیم خاص)، ۲) اسیدیته محیط (رهایش دارو در اثر تفاوت شرایط pH در بافت مورد درمان)، ۳) تفاوت دمایی (با توجه به شرایط دمایی بافت مورد نظر) و روشهای دیگری که به اختصاصات بافت تحت درمان وابسته است، انجام میشود[۷].
در شکل (۵) داروی آبدوست دوکسوروبیسین با گروههای عاملی آبگریز در تجمع خودآرایی ذرات نانومتری تشکیل میدهند. این نانوذرات با پوشش زیستسازگار پلیاتیلن گلیکول با تزریق درون وریدی وارد گردش خون موش آزمایشگاهی شده و به صورت غیرفعال در محل سلولهای سرطانی متمرکز میشود. افزایش جذب سلولی نانوذرات امکان رهایش دارو درون سلول و کاربرد درمانی موثرتری را فراهم میکند.
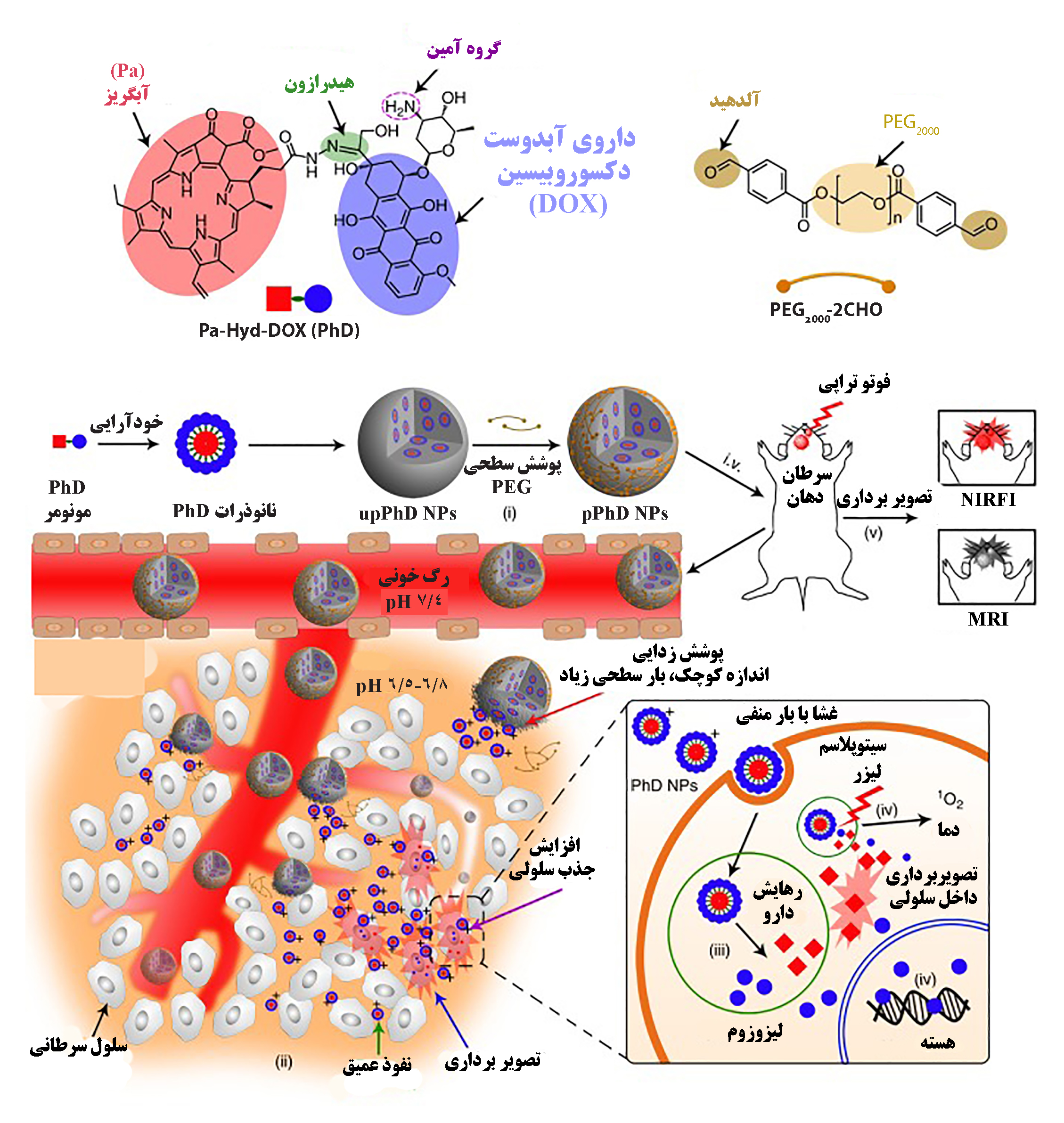
شکل ۵- هدفگیری غیرفعال داروی ضدسرطان آبدوست دکسوروبیسین با نانوذرات متصل به گروه عاملی [۹].
۳- عوامل موثر بر سازوکار هدفگیری غیرفعال
توزیع زیستی و سمیت سلولی نانوحاملها با خصوصیات فیزیکوشیمیایی و پاتوفیزیولوژیک آنها تعیین میشود. ماهیت شیمیایی، اندازه ذرات، میزان بار سطحی با تاثیر بر چسبندگی ذرات و تعامل آنها با سلول، تعیین کنندۀ مدت زمان گردش در خون، کارایی و مسیر جذب سلولی لیپوزومها، نقاط کوانتومی، نانوذرات پلیمری حامل دارو است. سامانههای آبگریز با بار الکتریکی زیاد، با سرعت بیشتری اوپسونیزه (جذب پروتئینهای پلاسمایی اوپسونین بر روی سطح) و حذف میشوند. بنابرین طراحی سامانهها با سطوح آبدوست و بار خنثی یا به مقدار کم آنیونی، کاربرد بهتری خواهد داشت[۸].
سایر عواملی که براساس EPR، هدفگیری تومور را تحت تاثیر قرار میدهند، اندازه نانومتری و زمان گردش در خون نانوحاملها است[۸]. اندازه ذرات، از نظر نفوذ و احتباس در تومور حائز اهمیت است. به عنوان مثال، اندازه ذرات باید طوری تنظیم شود که نفوذ ذرات به داخل بافت تومور و حفظ آنها در بافت امکانپذیر باشد[۱]. بر اساس مطالعات، دامنه اندازه بهینه در حدود ۲۰-۲۰۰ نانومتر است[۸]. نانوذرات بسیار کوچک (۲۰ نانومتر) به سرعت از طریق شکافهای بزرگ اندوتلیال وارد بافت تومور میشوند. اما با این حال، احتمال نگهداری آنها کاهش مییابد. زیرا به دلیل همین اندازۀ بسیار کوچک، به آسانی میتوانند از بافت تومور خارج شوند. نانوذرات بزرگتر (۵۰-۱۰۰ نانومتر) زمان گردش طولانیتری دارند و به این ترتیب زمان کافی برای سفر نانوذرات به بافت تومور و انتشار آن فراهم میشود. ذرات بزرگتر بسیار آهسته در بافت تومور پخش میشوند و درنتیجه تجمع بیشتری در آنجا دارند[۱]. علاوه بر اینها، عاملدار کردن سطوح نانوحامل با PEG با تغییر بارسطحی و درجۀ هیدراتاسیون، باعث جلوگیری از خود تجمعی و برهمکنشهای غیراختصاصی میشود[۸]. طول ایدهآل زنجیرۀسطحی PEG، بین ۱۵۰۰ تا ۵۰۰۰ دالتون گزارش شدهاست. به عنوان مثال مطالعات نشاندادهاند که مدت زمان گردش در خون نانوکپسولهای لیپیدی با ۲۰۰۰ دالتون PEG بر روی سطح، بیشتر از ۶۰۰ دالتون PEG است[۵].
|
کادر آموزشی: واحد دالتون مقیاسی برای وزن اتمی نسبی است. هرچند ارجاع به جرم اتمی به جای وزن اتمی معنای علمی دارد. اما بر اثر کاربرد طولانی به نوعی مجاز شمرده شده است. |
۴- کارآزماییهای بالینی نانوحاملها با هدفگیری غیرفعال
داروی دوکسوروبیسین[۹] انکپسوله در لیپوزومهای دارای گروع عاملی PEG، با نامهای تجاری Doxil از آمریکا و Caelyx از اروپا، اولین محصولی بود که در اواسط قرن ۱۹ وارد بازار شد. این فرمولاسیون، نیمه عمر داروی دوکسوروبیسین آزاد را از ۰/۲ ساعت تا ۵۵ ساعت افزایش داد. محصول Myocet، شامل دوکسوروبیسین در لیپوزومهای بدون عامل PEG، با نیمهعمر ۲/۵ ساعت و کاهش سمیت دارویی، اثرات ضدسرطانی بهتری از خود نشان دادند. با این حال در کارآزماییهای بالینی، هر دو نوع فرمولاسیون با اثربخشیهای مشابه، نسبت به داروهای آزاد سمیت قلبی عروقی کمتری داشتند. از طرف دیگر، لیپوزومهایی که برای درمان سرطان در مدت زمان طولانیتری درحال گردش سیستمیک هستند، به دلیل نشت از مویرگها، حساسیت و واکنشهای پوستی در دست و پا ایجاد میکنند. علاوه بر این مثالها، فرمولاسیونهای نانوذرهای دیگری به طور غیرفعال به سمت تومورها هدفمند شدهاند. امروزه لیپوزومها، میسلها، نانوذرات پلیمری در مراحل مختلف کارآزماییهای بالینی بررسی میشوند و بعضی از آنها، همانطور که در جدول۱ ذکر شده است، مورد پذیریش قرار گرفتهاند[۵].
جدول ۱- مثالهای مصارف بالینی نانوحاملهای هدفگذاری شده با روش غیرفعال[۵]
|
نوع نانوحامل |
نام تجاری |
هدف دارو |
وضعیت کارآزمایی بالینی |
|
لیپوزوم |
®Caelyx®/Doxil () |
سرطان تخمدان و سینه، سارکومای کاپوسی، میلوما |
پذیرفتهشده |
|
®Myocet ()
|
سرطان سینه |
پذیرفتهشده |
|
|
®DaunoXome () |
سارکومای کاپوسی |
پذیرفتهشده |
|
|
Onco-TCS () |
لنفوما |
پذیرفتهشده |
|
|
™SPI-077 () |
سرطان تخمدان، گردن، سر، ریه |
فاز ۲ |
|
|
میسل پلیمری |
Genexol®-PM () |
سرطان پانکراس، ریه و سینه |
فاز ۲-۴ |
|
™Nanoplatin () |
سرطانهای مختلف |
فاز ۱-۲ |
|
|
ترکیب نانوذرات/پلیمر/ دارو |
®Abraxane ()
|
سرطان سینه |
پذیرفتهشده |
|
®Transdrug ()
|
هپاتوکارسینوما |
پذیرفتهشده |
|
|
®Nanoxel (paclitaxel)
|
سرطان پیشرفتهی سینه |
فاز۱ |
|
|
®Xyotax (paclitaxel) |
سرطان سینه، تخمدان و ریه |
فاز ۲-۳ |
|
|
®Taxoprexin () |
انواع سرطانهای مختلف |
فاز ۲-۳ |
۵- جمعبندی و نتیجهگیری
نانوحاملها با عبور از فواصل بین سلولهای اندوتلیوم شبکۀ مویرگی سلولهای سرطانی، در بافت تومور جمع میشوند و به دلیل عدم عملکرد سیستم لنفاوی در آنجا باقی میمانند. در نظر گرفتن این اصل با عنوان اثر افزایش نفوذپذیری و ماندگاری، اهمیت ویژهای برای طراحی سامانههای دارویی در روش هدفگیری غیرفعال دارد. هدفگیری داروهای ضدسرطان باعث کاهش عوارض جانبی داروهای بسیار سمی، افزایش اثربخشی و تحویل مولکولهای دارویی با انحلالپذیری ضعیف یا نیمه عمر کوتاه به سمت بافت هدف میشود. در حال حاضر سازوکارهای هدفگیری غیرفعال نانوحاملهای مختلف مثل لیپوزوم، میسل و نانوذرات پلیمری مراحل مختلف کارآزماییهای بالینی را پیش رفته و بعضی از آنها مورد پذیرش قرار گرفتهاند.
۶- مراجع
[1]Alexander-Bryant, Angela A., Wendy S. Vanden Berg-Foels, and Xuejun Wen. "Bioengineering strategies for designing targeted cancer therapies." Advances in cancer research. Vol. 118. Academic Press, 2013. 1-59.
[۲] فاطمه وطنزاده، فرشته رضایی، مهدی قلعه جیعی پور. نانوذرات در دارورسانی هدفمند و درمان سرطان، دومین کنفرانس بینالمللی مهندسی برق، اردبیل، ۱۳۹۶, ۳۵-۴۲
[3] Huynh, Ngoc Trinh, et al. "The rise and rise of stealth nanocarriers for cancer therapy: passive versus active targeting." Nanomedicine 5.9 (2010): 1415-1433.
[4] Kim, Susy M., Peggy H. Faix, and Jan E. Schnitzer. "Overcoming key biological barriers to cancer drug delivery and efficacy." Journal of Controlled Release 267 (2017): 15-30.
[5] Hirsjarvi, Samuli, Catherine Passirani, and Jean-Pierre Benoit. "Passive and active tumour targeting with nanocarriers." Current drug discovery technologies 8.3 (2011): 188-196.
[6]Zhang, RuiXue, et al. "Design of nanocarriers for nanoscale drug delivery to enhance cancer treatment using hybrid polymer and lipid building blocks." Nanoscale 9.4 (2017): 1334-1355.
[۷] سید محمدجواد حسینی زاده. "مروری بر مهمترین مکانیسمها و سیستمهای دارورسانی هدفمند". فصلنامه بیولوژی کاربردی, ۶, ۲۱, ۱۳۹۵, ۱۷-۲۸.
[8]Attia, Mohamed F., et al. "An overview of active and passive targeting strategies to improve the nanocarriers efficiency to tumour sites." Journal of Pharmacy and Pharmacology 71.8 (2019): 1185-1198.
[9] Xue, Xiangdong, et al. "Trojan Horse nanotheranostics with dual transformability and multifunctionality for highly effective cancer treatment." Nature communications 9.1 (2018): 3653.
۷- پاورقی
[1]apoptosis
[2]Angiogenesis
[3]Hypoxic
[4]Glycolysis
[5]opsonins
[6]Phagocytosis
[7] “stealth” nanocarriers
[8] Enhanced permeability and retention
[9]Doxorubicin