شنبه 05 مهر 1399 کد خبر: 16

۱-مقدمه
به کارگیری محصولات فناوری نانو، مستلزم ارزیابی دقیق برهمکنشهای بیولوژیکی نانومواد و اجزای سلولی است. برای تعیین سمیت غیرمنتظره نانومواد، باید رابطهی بین خصوصیتهای فیزیکی وشیمیایی نانوساختارها و القا پاسخهای بیوشیمیایی در سلولها بررسی شود. سازوکار اصلی مولکولی سمیت مواد در محیط درونتن، شکلگیری رادیکالهای آزاد اکسیژن و القای استرس اکسیداتیو در سلولهای زنده است. گونههای اکسیژنی فعال با پراکسیداسیون چربیها، تغییر پروتئینها، شکست DNA و اختلال در همانندسازی ژن منجر به آسیب سلولی و در نهایت باعث ایجاد سرطان، تحلیل سیستم عصبی بیماریهای کلیوی، ریوی و قلبی میشوند.
واکنشهای متقابل نانومواد با میتوکندری، غشای پلاسمایی و هسته، مراکز مهم سمیت سلولی هستند[۱]. مطالعات سازمانیافته درمورد تاثیرات زیستی نانوذرات و سازوکار آنها، نه تنها سلامتی انسان و محیط زیست را حفظ میکند، بلکه باعث افزایش کاربرد ایمن نانوذرات در مصارف مختلف پزشکی و تکنولوژی میشود[۲]. تاکنون اطلاعات کمی درمورد سازوکار سمیتزای نانومواد به دست آمدهاست. در این مقاله سمیت نانومواد اکسیدی، کربنی و نقاط کوانتومی را بررسی کرده و با مسیرهای آسیبرسان به سلولهای زنده آشنا میشویم.
۲- سازوکارهای ایجاد سمیت
مطالعات سمشناسی درمورد سازوکارهای سمیتزای نانوذرات، به دوصورت برونتنی[۱] در محیط آزمایشگاه و آزمایشهای درونتنی[۲]،در بدن حیوانات مدل و انسان بررسی میشود. قابلیت زیستی سلولهای زنده پس ازتماس نانوذرات، با دو سازوکار کلی وابسته به تولید گونههای فعال اکسیژن و مستقل از گونههای فعال اکسیژن[۳] تغییر میکند[۲]. شدت پاسخ دو سطح سلولی و سامانههای زیستی، نسبت به نانوذرات در دستههای فلزی و غیر فلزی، با اندازه، شکل و ویژگیهای سطحی مختلف، متفاوت است[۳].
۱-۲- سازوکارهای ROS
گونههای فعال یا رادیکالهای اکسیژن به دلیل داشتن جفت الکترونهای آزاد، تمایل زیادی برای واکنش با سایر ترکیبات شیمیایی دارند[۲]. بنابراین تولید گونههای فعال اکسیژن یکی از مهمترین سازوکارهای سمیت سلولی نانوذرات است[۴]. در سلولهای زنده پس از مواجهه با نانوذرات، به دلیل واکنشهای شیمیایی و برهمکنشهای فیزیکی ذرات با اجزای سلولی درگیر در فرآیندهای زیستی اکسیداسیون و احیا، در سطح بالایی گونههای فعال اکسیژن با خاصیت اکسیدان قوی تولید میشود. این ترکیبات با حملهی اکسایشی، در آبشار تغییرات بیوشیمیایی مولکولهای کنترلکنندهی تکثیر سلولی، فرآیندهای التهابی و مرگ سلولی، اثر میگذارند.
۱-۱-۲- شکلگیری رادیکالهای آزاد اکسیژن
اکسیژن مولکولی محلول در مایعات زیستی، تحت تاثیر انرژی نورانی مورد نیاز برای واکنشهای انتقالی زیستی، به اکسیژن یگانه ()تبدیل میشود. رادیکال سوپراکسید ()، با یک واکنش کاهشی مولکول اکسیژن به وجود میآید (معادله۱). این واکنش میتواند در اثر چرخه ردوکس، یا به صورت آنزیمی با کاتالیزگری NADPH oxidase و همچنین به عنوان محصول فرعی واکنشهای آنزیمی با Xanthin oxidase و محصول جانبی زنجیره انتقال الکترون در میتوکندری انجام شود[۴]. نانومواد با تنظیم بالادست آنزیمهای گزانتین اکسیداز و NADPH اکسیداز، باعث افزایش تولید رادیکال سوپراکسید در برخی سلولها مثل ماکروفاژها و نوتروفیل ها میشوند و واکنش های التهابی را راهاندازی میکنند[۱].
(۱)
آنیون سوپراکسید بهطور ناگهانی یا کاتالیزگری آنزیم سوپراکسید دیسموتاز و با کمک مس، منگنز یا روی به عنوان کوفاکتور به هیدروژن پراکسید(H2O2) تبدیل میشود (معادله۲)[۴].
(۲)
انحلال نانومواد با پایه آهن یا مس[۴] شکلگیری گونههای اکسیژنی فعال را کاتالیز میکند و از طریق واکنش فنتون[۴] منجر به تولید رادیکالهای آزاد هیدروکسیل(OH) و رادیکال پراکسیل(OOH) میشود[۳].
در معادلات بالا و شکل۱، سازوکارهای آنزیمی و غیر آنزیمی ایجاد گونههای فعال اکسیژن مثل اکسیژن یگانه، سوپراکسید، هیدروژن پراکسید، رادیکال هیدروکسیل و رادیکال پراکسیل نمایش داده شدهاست. برای مثال نانوذرات TiO2 با کاربرد در کرمهای ضد آفتاب، تحت تاثیر اشعه نور خوشید، اکسیژن یگانه و سوپراکسید تولید میکنند[۴]. افزایش سطح ROS، منجر به بروز پاسخهای التهابی از قبیل افزایش سلولهای با هستهی چندشکلی شده واختلال در فرآیند فاگوسیتوز ماکروفاژها در برخی حیوانات مدل مثل جوندگان میشود[۳].
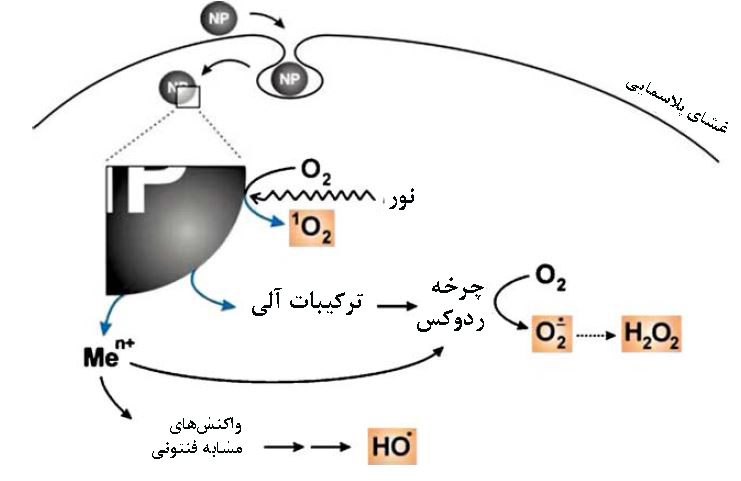
شکل۱- تولید گونههای فعال اکسیژن در اثر مواجهه با نانوذرات[۴].
۲-۱-۲- چگونگی عمل رادیکالهای آزاد
با اضافه شدن یک رادیکال آزاد به مولکول دیگر، یک ترکیب رادیکالی ایجاد میشود. رادیکالهای فعال معمولا در واکنشهای زنجیرهای، ترکیبات بیوشیمایی را اکسیداسیون یا احیا میکنند[۵]. در شکل۲، زیرساختارهای فرضی مورد هدف نانوذرات نمایش داده شدهاست. گونههای اکسیژنی فعال میتوانند الکترونها را از لیپیدهای موجود در غشای سلول بگیرند و یا با تغییر بار الکترواستاتیکی پروتتئینهای غشایی، باعث کاهش عملکرد فیزیولوژیکی و مرگ سلول شوند[۳]. غشای پلاسمایی احاطه کننده سلول و اندامکهای مهم مثل هسته، میتوکندری و شبکه اندوپلاسمی با اثر کمپلکسهای آنزیمی ردوکس و گونههای فعال اکسیژن، استحکام، یکپارچگی و نفوذپذیری انتخابی خود را از دست میدهند. نشت کلسیم از ذخایر شبکه اندوپلاسمی، در آبشار وقایع پیامرسانی سلولی را اثر کرده و نوعی سمیت سلولیناشی از افزایش کلسیم ایجاد میشود[۴]. وسعت سمیت و آسیب ناشی از ROS، نه تنها به نوع و دوز گونههای فعال، بلکه به نوع سلول، مدت زمان قرارگیری در معرض رادیکالهای آزاد و عوامل خارج سلولی نظیر دما، فشار اکسیژن، ترکیب یونها، پروتئینها و میزان حذف ROSها نیز بستگی دارد[۵].
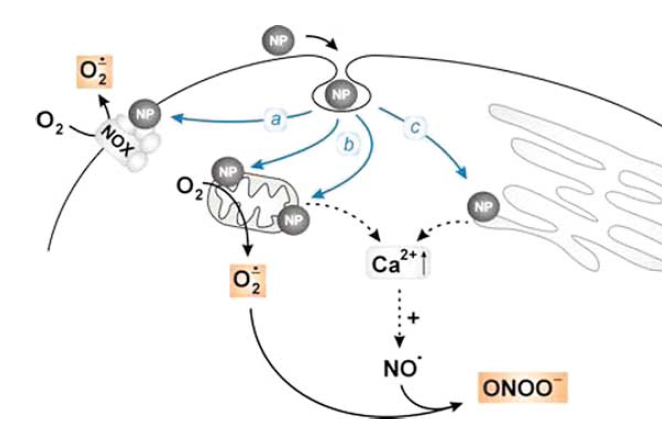
شکل۲- برهمکنشهای فیزیکی نانوذرات با اجزای سلولی. الف) برهمکنش نانوذرات با کمپلکس آنزیمیNADPHاکسیداز (NOX) ب)میتوکندری، ج) شبکه اندوپلاسمی[۴].
۳-۱-۲- آنتی اکسیدانها
اکسیژن برای بقای سلولهای زنده ضروری است اما متابولیتهای ناشی از آن باید به صورت مداوم غیرفعال شوند[۵]. سیستم ایمنی و دفاعی بدن با کمک آنتیاکسیدانها در برابر رادیکالهای آزاد اکسیژن مقابله میکند و با برقراری تعادل در واکنشهای اکسایش و احیا، نقش مهمی در ایمنی سیستمهای زنده دارند. آنتیاکسیدانهایی نظیر کاتالاز و سوپراکسید دیسموتاز، به صورت آنزیمی رادیکالهای آزاد را حذف میکنند. گونههای غیرآنزیمی از قبیل ویتامین A وC، آلبومین و تیروکسین، رادیکال پراکسید و هیدروکسیل را به آب تبدیل میکنند.
پروتئینهایی مثل چاپرون، مولکولهای زیستی را در برابر آسیبهای اکسیداتیو حفظ میکنند. مولکولهایی مثل گلوتاتیون و اسیداوریک دارای وزن مولکولی پایین هستند و میتوانند انواع رادیکالهای آزاد اکسیژن و نیتروژن را به دام بیاندازند. درواقع مجموعه دفاع آنتیاکسیدان، با جلوگیری از ایجاد انواع فعال اکسیژن، برطرف کردن آسیبهای ناشی از رادیکالهای آزاد، از بین بردن محصولات فرعی، جانبی و زاید اکسیژن، از بدن محافظت میکنند[۵].
۴-۱-۲- استرس اکسیداتیو
استرس اکسیداتیو در اثر غلبهی رادیکالهای آزاد بر آنتی اکسیدان ایجاد میشود و از اصلیترین سازوکارهای سمیت بیشتر نانوذرات فلزی مثل طلا، اکسیدروی و نقره است[۲]. استرس اکسیداتیو با تنظیم بالادست فاکتورهای رونویسی حساس به ردوکس، برخی آنزیمهای کینازی و پروتئینهای حدواسط واکنشهای التهابی را فعال میکنند و باعث آسیبهای بافتی مثل آسیب به غشا سلولی، ماده ژنتیکی و ماکرومولکولهای زیستی میشوند[۱]. در سطوح بسیار بالا، اختلال در مسیرهای پیامرسانی درون سلول، منجر به آپوپتوز و نکروز سلولی میشود. گونههای فعال اکسیژن، با پراکسیداسیون اسیدهای چرب غیراشباع سلولهای نورونی، عملکرد سامانه عصبی مرکزی را مختل میکنند. گرفتگی عروق، فشار خون و تنگی مجدد شریانها پس از آنژیوپلاستی در اثر ROS باعث اختلالات سیستم قلبی عروقی میشود.
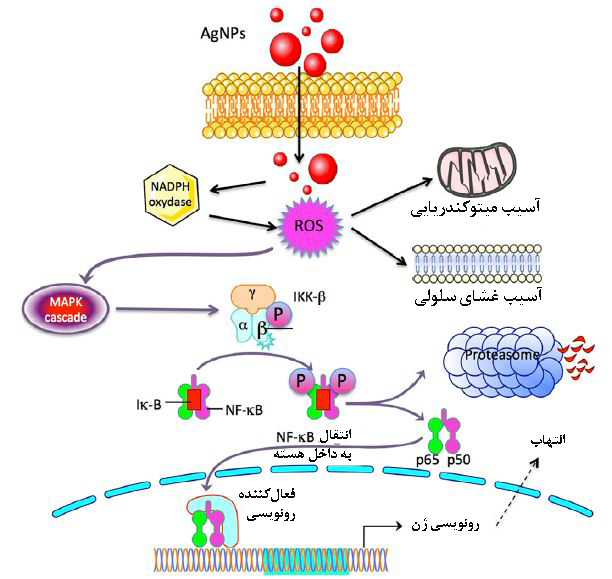
شکل۳- راهاندازی واکنشهای التهابی در اثر سازوکار سمیت وابسته به ROS توسط نانوذرات نقره[۶]
میتوکندری به واسطه زنجیره تنفسی انتقال الکترون، یکی از منابع اصلی تولید ROS است[۵] چندین سندروم بالینی مانند سکته مغزی، تحلیل عضلانی دوشن، نقص در هدایت الکتریکی قلب در اثر حمله اکسایشیROS و شکست دورشتهای DNA میتوکندریایی به وجود میآید[۳]. نانوذرات با تولید گونههای فعال اکسیژن، در ساختار شیمیایی هیستونها یا سایر پروتئینهای موثر در شکلدهی ساختار DNA، تغییر ایجاد میکنند. باز شدن ساختار مارپیچی DNA، باعث اختلال در بیان ژن و نقص تنظیم عملکرد سلولی میشود[۵].
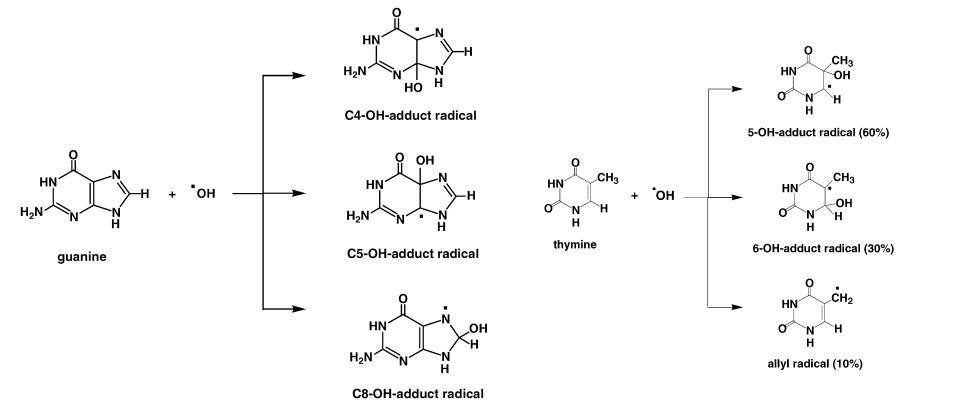
شکل۴- نحوه تغییر بازهای آلی DNA توسط ROS.
۲-۲- سازوکارهای مستقل از ROS
برخی نانوذرات علاوه بر سمیت ROS، با رهاسازی یونهای فلزی، تجمع در برخی اجزای سلولی و برهمکنش با اجزای هستهای، سازوکارهای موثر دیگری برای آسیب سلولی به کار میگیرند[۵].
۱-۲-۲- نانوذرات اکسیدی
نانوذرات اکسیدروی یکی از پرمصرفترین مواد اکسیدی در صنایع مواد آرایشی، غذایی، الکترونیک و انرژی است. براساس تحقیقات برونتنی، اکسیدروی با سازوکار ROS و آزاد شدن یونهای ، جهت تخریب سلولی عمل میکند. مطالعات درونتنی، شکل جدیدی از سمیت بافتی، ناشی از تجمع نانوذرات اکسیدروی در لایههای پوستی نشان دادهاست. با توجه به این که نانوذرات اکسیدروی قابلیت عبور از لایههای سلولی پوست را ندارند، در همان لایههای اولیهی پوست باقی میمانند و با جذب فوتونهایی از نور خورشید که دارای انرژی معادل باند انرژي نانوذرات اکسیدروی است، نوعی سمیت نوری ایجاد میکنند. در اثر سمیت نوری واکنشهای ROS اتفاق میافتد و تاثیرات مخربی بر سلولهای پوستی ایجاد میکند[۱۲].
۲-۲-۲- نانوذرات کربنی
نانوذرات با پایهی کربن، چربیدوست هستند و به راحتی میتوانند از عرض غشاهای مختلفی عبور کنند. نانوموادی که مثل فولرن (C60) انحلالپذیری کمی دارند، در مایعات زیستی کلوخه میشوند[۱۲]. با بررسی سطوح زیرسلولی دیده میشود که فولرن به صورت واحدهای هگزاگونال در اجزای سلولی تجمع مییابد. سمیت فولرن اغلب وابسته به دوز است و نسبت به سایر نانوذرات حداقل سمیتزایی را دارد[۸]. سمیت نانولولههای کربنی اغلب ناشی از آگلومرهشدن، ناخالصیهای دیواره، گروههای عاملی متصل به سطح، طول لوله و تعداد لایهها است. ناخالصیهایی نظیر کبالت، نیکل و آهن در نانولههای تجاری وجود دارد و موجب آزاد شدن یونهای فلزی یا القای واکنشهای ROS میشوند. در مطالعات گزارش شده است که اغلب نانولولههای تکلایه، طویل و با قابلیت آگلومرهشدن، سبب مرگ سلولی میشوند[۹].
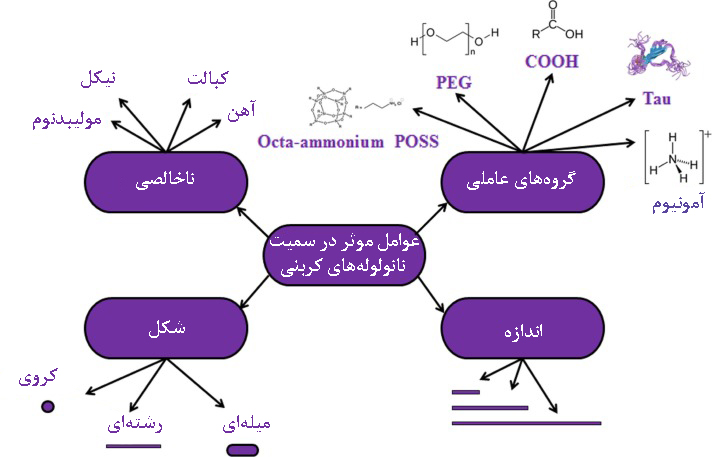
شکل۵- تاثیر مشخصات فیزیکوشیمیایی مختلف نانولولههای کربنی در سمیت[۸]
۳-۲-۲- نقاط کوانتومی
نقاط کوانتومی به واسطهی پایداری نوری ویژه و تنوع طولموج، کاربرد زیادی در فتودینامیک درمانی، رهایش دارو[۲]، تصویربرداریهای in vivo و in vitro دارند[۸]. اما با توجه به اثرات نامطلوب آنها بر روی سلولها و سیستمهای زیستی، استفاده از نقاط کوانتومی برای درمان بیماری بسیار محدود شدهاست. نقاط کوانتومی بلورهای نانومتری با ساختار متشکل از هسته و پوسته نیمه هادی است. هسته معمولا از موادی نظیر GaAs وPbS ،CdSe ساخته میشود و پوسته میتواند از ترکیباتی مثل ZnS باشد[۲].
سمیتزایی نقاط کوانتومی، به علت رها کردن یونهای فلزی مثل ، سرب و یا آرسنیک از هستهی خود[۱۰] و ایجاد مشکلات عصبی، تغییر شکل استخوان، سرطان و اثر بر کبد و کلیه است. نقاط کوانتومی با تابشدهی نوری و با کاهش آنتیاکسیدانهای درون سلولی، تشکیل گونههای فعال اکسیژن را القا میکنند. با بهم خوردن تعادل اکسایشی درون سلول، پتانسیل غشای میتوکندری کاهش مییابد، دو رشته DNA تخریب شده و مکانیسمهای ترمیمی غیرفعال میشوند. افزایش سطح ROS، مسیرهای پیامرسانی درونسلولی وابسته به کلسیم را مختل کرده و در نهایت آپوپتوز را القا میکند[۶]. شواهدی در دست است که نشان میدهد نقاط کوانتومی با نفوذ به درون سلولها باعث افزایش سیالیت غشا میشوند و از طرف دیگر با پراکسیداسیون لیپیدهای غشایی در اثر تولید ROS، انعطافپذیری غشا را کاهش میدهند[۱۰]. مجموعهی اختلالات غشای پلاسمایی، مستقیما با از بین رفتن پایداری سلول در ارتباط است و منجر به مرگ سلولی میشود. هرچه اندازه ذرات کوانتومی کادمیومی کوچکتر باشد، رهایش یون کادمیوم بیشتر خواهد بود.در واقع شکل کریستالی و عوامل سطحی مثل NH2 و COOH نیز در فرآیند سمیتزایی نقاط کوانتومی، نقش بهخصوصی دارند[۶].
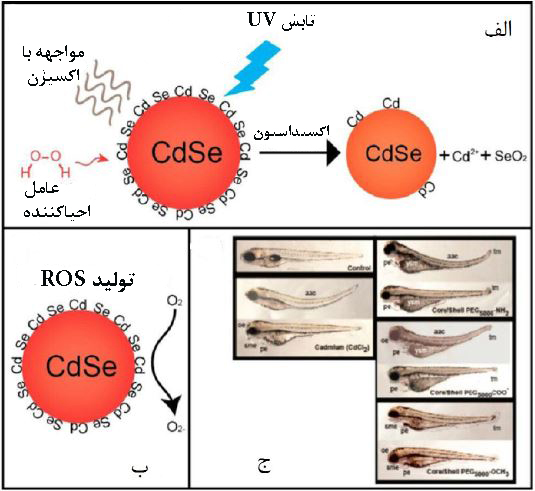
شکل۶- الف) رهایش یون کادمیوم از نقاط کوانتومی. ب)ایجاد ROS در حضور نقاط کوانتومی. ج)تاثیر نقاط کوانتومی در انحنای ستون فقرات ماهی قزلآلا[۵]
۳- سمیت سلولی
یک سلول زنده، مجموعهای از اجزای ریزمقیاس با وظایف و عملکرد مشخص است. غشای پلاسمایی محتویات سلولی را احاطه کرده و در مواجهه با محیط بیرونی قرار دارد. نفوذپذیری انتخابی غشا، با کمک سازوکارهای مختلف انتقال مواد، پایداری سلول را حفظ میکند. نانوذرات با اندازهی کوچک، بهراحتی از عرض غشا عبور میکنند و با توجه به خواص سطحی ویژهی خود، با اجزای مهم سلولی از قبیل میتوکندری، لیزوزوم و هسته تعامل دارند.
پیوستگی ساختار و حفظ عملکرد سلولها، اغلب به وسیلهی ماکرومولکولهای زیستی مثل کربوهیدارتها، لیپیدها و بهطور ویژه پروتئینها تعیین میشود. ساختاربندی مولکولهای زیستی، تحت تاثیر برهمکنش با انواع نانوذرات تغییر میکند[۱۱]. شکل۷، سازوکارهای مختلف سمیت سلولی نانوذرات را نشان میدهد.
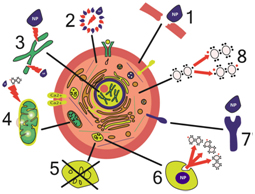
شکل۷-سازوکارهای آسیب سلول توسط نانوذرات. (۱)آسیب فیزیکی غشاها. (۲)تغییرات ساختاری در اجزای اسکلت سلولی (۳)اختلال در رونویسی و آسیب اکسیداتیو (۴)آسیب به میتوکندری (۵)اختلال در عملکرد لیزوزوم (۶)تولید گونههای فعال اکسیژن (۷)اختلال در عملکرد پروتئینهای غشایی (۸)سنتز عوامل التهابی و واسطهها[۱۰]
۴-جمعبندی و نتیجهگیری
سمیت نانومواد در سطح سلولی، عملکرد هر سامانهی زیستی را تحت تاثیر قرارمیدهد. آسیب احتمالی نانومواد ناشی از استرس اکسیداتیو، میتواند شامل عفونت، اختلال در میتوکندری، تغییر در نظم چرخه سلولی، تخریب ماکرومولکولهای زیستی و مهار عملکردهای حیاتی سلولی باشد. نانوذرات اکسیدی یا ناخالصیهای موجود در نانوذرات کربنی، با آزادکردن یونهای فلزی به طور مستقیم با اجزای سلولی واکنش میدهند. تاکنون سازوکارهای زیادی از سمیت نانوذرات شناخته شدهاست. بنابراین، دستهبندی و تعیین انواع مکانیسمهای ایجاد سمیت، با توجه به ویژگیهای فیزیکی و شیمایی هر ذره خاص، ضروری است.
۵- مراجع
[۱]مهدیه رزمی، عادله دیوسالار، سمیت شناسی برخی از نانوساختارها، کنفرانس علوم و فناوری نانو، دانشگاه پیام نور استان یزد،سال۸۹، صفحه ۱۷۸۲ تا ۱۷۸۵
[۲]سیامک علیپور، محمد مالکی، مروری بر سمیت نانومواد و ایمنی در محیط کار و آزمایشگاه، فصلنامه علمی، شماره ۲، سال ۹۶، صفحات ۶۹-۷۷
[۳]عمید رهی، نغمه ستاراحمدی، حسین هلی، سمیت نانو مواد- تاثیر خواص فیزیکوشیمیایی، دانشگاه علوم پزشکی شهید صدوقی یزد، شماره ۶، سال۹۳، صفحه های ۱۷۳۷-۱۷۵۴
[4]Unfried, Klaus, et al. "Cellular responses to nanoparticles: target structures and mechanisms." Nanotoxicology 1.1 (2007): 52-71.
[۵]مهدی کمالی، علی اکبر رستمی، هما محسنی، سمیت سلولی نانوذرات در محیط Invitro، تازههای بیوتکنولوژی سلولی-مولکولی، شماره ۱۲، سال ۹۲، صفحه۶۵-۷۲
[6] Gaillet, Sylvie, and Jean-Max Rouanet. "Silver nanoparticles: their potential toxic effects after oral exposure and underlying mechanisms–a review." Food and Chemical Toxicology 77 (2015): 58-63.
[7]Jang, Yeon Sue, et al. "The potential for skin irritation, phototoxicity, and sensitization of ZnO nanoparticles." Molecular & Cellular Toxicology 8.2 (2012): 171-177.
[۸] حسین قنبری، سازگاری زیستی در مقیاس نانو، اول، تعالی اندیشه، سال۱۳۹۴.
[9]Liu, Ying, et al. "Understanding the toxicity of carbon nanotubes." Accounts of chemical research 46.3 (2012): 702-713.
[10]Sukhanova, Alyona, et al. "Dependence of nanoparticle toxicity on their physical and chemical properties." Nanoscale research letters 13.1 (2018): 44.
[۱۱]معصومه تاران، قاسم عموعابدینی،فائزه کاشانیان، بررسی سمیت نانوذرات در مواجهه با سلول، ایمنی زیستی، شماره اول، سال ۹۲، صفحه های ۵۵ تا ۷۰
۶- پاورقیها
[1]In-vitro
[2] In-vivo
[3] Non-ROS
[4]Fenton