شنبه 27 دی 1399 کد خبر: 81

۱- مقدمه
روشهای متعارف رهاسازی دارو در بدن، عمدتا از دو راه گوارشی (قرص، کپسول، شربت) و غیرگوارشی (مانند تزریق، قطرههای چشمی، کرمهای موضعی)، در فواصل زمانی مشخص مصرف دارو، صورت میگیرد. در اغلب این روشها، مسیر پیمایش دارو در بدن، طی مواجهه با محیط اسیدی معده، عبور از اتصالات سخت سلولهای دیوارۀ روده و با ورود به چرخه درون کبدی همراه است که درنهایت جذب گردش خون میشود[۱]. در حال حاضر بیشتر داروها از طریق شیوههای سنتی و جذب سیستمیک به محل اثر خود میرسند و با هدر رفتن دارو در طول عبور از دستگاه گوارش، دستگاه گردش خون و بافتهای حدواسط، دوز دارویی به صورت غیرواقعی و بیشتر از مقدار مورد نیاز برای درمان به کار میرود. پایههای این نگرش بر این اساس است که اگر غلظت کافی از دارو وارد گردش خون شود، بالاخره مقداری از آن برای درمان بیماری به محل اثر خود میرسد ولی با این حال، میزان زیادی از دارو در بافتهای سالم بدن، عوارض جانبی ایجاد میکند[۲].
فرآیند دارورسانی هدفمند، موجب حفظ سطح غلظتهای مناسب دارویی در مدت زمان طولانی میشود و موجب کاهش بسیاری از محدودیتهای متعارف درمانی مانند تعداد دوزهای مصرفی، غلظت اولیه دارویی و همچنین عوارض جانبی ناشی از انتشار ساده دارو در توزیع سیستمی نامشخص میشود. هر سامانۀ تحویل هدفمند، شامل یک دارو، حامل و یک لیگاند هدفگذاری است که در آن، چگونگی توزیع، متابولیسم و جذب سلولی دارو، با توجه به خصوصیات فیزیکوشیمیایی و رفتار بیولوژیک حامل و لیگاند تعیین میشود. بنابراین طراحی حامل و لیگاند مناسب، باعث افزایش کارایی دارو در بافت بیمار و کاهش سمیت دارو در سایر بافتهای سالم میشود[۳]. در این مقاله سازوکارهای کنترل رهایش دارو و روشهای مختلف هدفگیری فیزیکی بررسی میشوند.
۲- پروفایل رهایش دارو
مشخصات رهایش دارو، نتیجهای از یک یا چند سازوکار مشخص آزادسازی، درون بدن است که عبارتند از: ۱) آزاد سازی داروی متصل شده به سطح، ۲) انتشار از عرض ماتریکسهای حامل، ۳) انتشار از دیواره میکروکپسولها و میکروذرات، ۴) فرسایش و تخریب ماتریکس حامل و ۵) مکانیسم ترکیبی از فرآیند فرسایش/انتشار[۴]. در شکل۱، مهمترین سازوکارهای رهاسازی دارو از سامانههای پلیمری نمایش داده شده است.
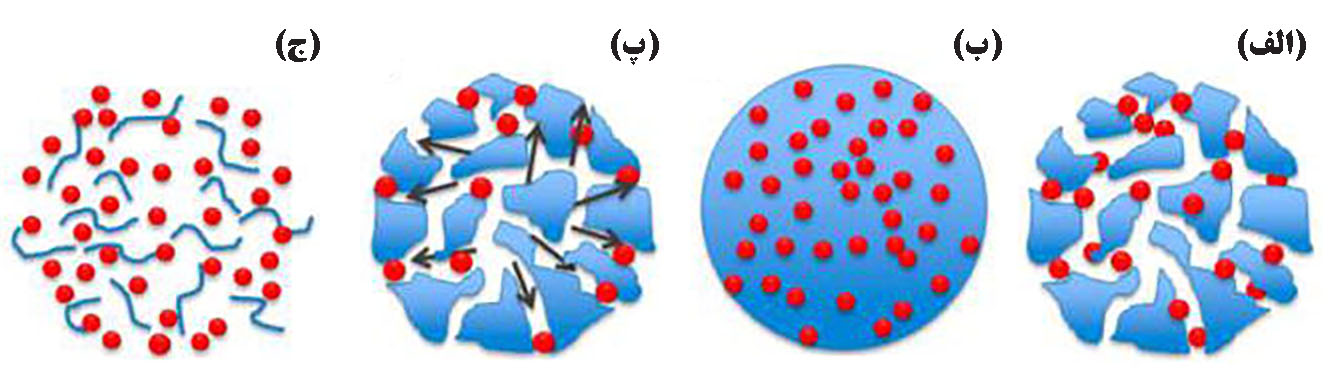
شکل۱- مشخصات رهایش دارو. الف) انتشار دارو از منافذ آبی، ب) انتشار از دیواره ماتریکس پلیمری، پ) پمپ اسمزی و ج) فرسایش. [۵]
ویژگیهای رهاسازی دارو بدون استفاده از حامل، در شکل ۲-الف نمایش داده شده و تنها مزیت فرمولاسیونهای معمولی، کمتر بودن هزینۀ تولید و توسعۀ آنها است. درمورد بیشتر داروها هرچه غلظت پلاسمایی دارو بیشتر باشد، میزان تخریب و حذف دارو از خون نیز بیشتر میشود. در ابتدای تجویز درون وریدی، یا اندکی بعد از جذب خوراکی دارو به گردش خون، غلظت دارویی در بیشترین مقدار است. در این زمان نرخ تخریب دارو با توجه به شیب تند منحنی حذف دارو بیشتر است و هرچه به انتهای نمودار نزدیک میشویم و غلظت پلاسمایی دارو کم میشود، میزان حذف هم کمتر میشود. از طرف دیگر، شکل ۲-ب، ویژگیهای رهایش دارو با سامانههای نانومتری سادۀ درجه-صفر را نشان میدهد. در این سامانهها، نرخ تخریب مواد در پلاسمای خون ثابت است[۶] و نیمه عمر آن از چند ساعت تا چند ماه میتواند متغیر باشد. توسعۀ بیشتر سامانههای دارورسانی هدفمند نانومتری، با توجه به شرایط درمان و نیازهای بیماری، امکان بهتری از جهت قابلیت برنامهریزی در رهایش دارو دارند. (شکل ۲-ج) در نانوسامانههای حامل دارو، امکان کپسوله کردن چندین دارو با مکانیسمهای تعاملی مختلف در داخل یک ماتریس وجود دارد و همچنین با استفاده ازسامانههای نانومتری حساس به محرک، برنامهریزی رهایش دارو، به خوبی قابل تنظیم است[۴].
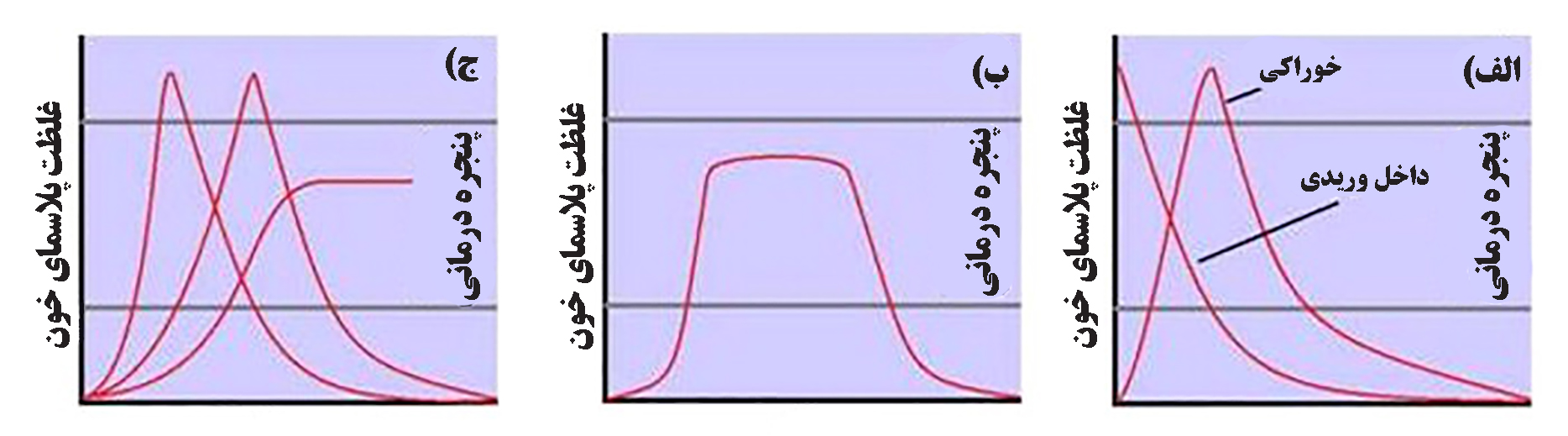
شکل۲- مشخصات رهایش و حذف دارو. پنجره درمانی نشاندهنده غلظتهای مختلف یک دارو در گردش خون بدن است که اثرات درمانی ایمنی فراهم میکند. الف) رهایش دارو بدون حامل، ب) رهایش دارو با سامانهي درجۀ صفر، ج) رهایش دارو با سامانۀ نانومتری[۴]
۳- کنترل رهایش دارو
استفاده از سیستمهای دارورسانی سنتی، در فواصل زمانی مشخص، هیچ کنترلی در زمان، مکان و سرعت رهایش دارو ندارد. همچنین تحویل دارو در بافت هدف، باید تا زمان معرف بعدی، نیاز درمانی بیمار را برطرف کند و در نوبتهای متناوب مصرفی، ممکن است نوسانات غلظت دارو، از گسترۀ درمانی فراتر رفته و عوارض جانبی بیشتری ایجاد کند[۲]. از طرف دیگر، بسیاری از داروها ناپایدار و سمی بوده و دوره اثربخشی آنها کوتاه است. بعضی از داروها هم ممکن است مشکل انحلالپذیری داشته باشند. برای حل این مشکلات، سیستمهای نانومتری حامل دارو، ویژگیهای مطلوبی برای کپسوله کردن بسیاری از داروها و مواد تشخیصی تصویربرداری دارند و ضمن محافظت از دارو در حین فرآیند انتقال، رهایش کنترل شده و تحویل به بافت هدف، روشی برای محافظت بدن در برابر داروهای بسیار سمی است[۷].
سیستمهای انتقال دارو در چند سال گذشته اهمیت بیشتری پیدا کردهاند. نکتۀ قابل توجه درمورد آنها، این است که هرکدام از سامانههای دارویی دارای خصوصیات شیمیایی، فیزیکی و مورفولوژیکی خاص خود هستند و با فعل و انفعالات شیمیایی مختلفی مثل پیوندهای کوالانسی، هیدروژنی و یا با تعاملهای فیزیکی مثل برهمکنشهای الکترواستاتیک و واندروالس، تمایلات اتصالی مختلفی به انواع داروهای قطبی و غیرقطبی دارند. علاوه بر این، عوامل دیگری مثل ترکیب شیمیایی نانوذرات و انواع اشکال مختلفی از نانوسامانهها که با دارو در ارتباط هستند، نقش مهمی در پروفایل رهایش کنترلشدۀ دارو دارند. به طور کلی رهاسازی دارو از سامانههای نانومتری حامل دارو، از طریق سازوکارهای مختلف انتشار، انحلالپذیری، واکنش شیمیایی و رهاسازی وابسته به دریافت یک محرک خاص صورت میگیرد[۲].
۴- هدفگیری فیزیکی
یکی از روشهای برنامهگذاری برای آزادسازی داروها، استفاده از سامانههای دارویی پاسخگو به محرک است. این سامانهها در اثر تغییر ساختار، حلالیت، شکل، اندازه یا بارسطحی خود به دنبال پاسخ به یک یا چند محرک، بار دارویی خود را در محل مورد نظر رها میکنند. محرکها را میتوان با توجه به منشا آنها (داخلی و خارجی) یا نوع سیگنال (شیمیایی یا فیزیکی) طبقهبندی کرد[۴]. همانطور که در شکل ۳ نیز نمایش داده شده، برخی سامانههای دارویی با هدفگیری فیزیکی به نیروهای مختلف خارجی نظیر میدان مغناطیسی، فراصوت، نور، حرارت و میدان الکتریکی، در رهایش عوامل دارویی پاسخ میدهند. به نظر میرسد از بین این موارد، استفاده از میدان مغناطیسی، میدان الکتریکی (الکتروپوراسیون)[۱]، نور و امواج فراصوت کاربرد گستردهتری داشته باشد[۳].

شکل۳-سامانههای دارورسانی هدفمند با نیروهای فیزیکی[۸]
۱-۴- نانوذرات و میدان مغناطیسی
در مهندسی زیستپزشکی[۲]، نانوذرات مغناطیسی به دلیل خصوصیات منحصر به فرد خود از قبیل: ۱) برهمکنش دوقطبیهای مغناطیسی که در اثر یک میدان مغناطیسی خارجی، منجر به تجمع نانوذرات در بافت مورد نظر میشود. ۲) امکان بهینهسازی با عاملدار کردن و افزایش سازگاری زیستمحیطی ۳) تخصصی شدن با استفاده از لیگاندهای هدفگذاری[۳]، در مقاصد مختلفی از جمله: ۱) جداسازی مغناطیسی سلولها و اجزای زیستی، ۲) دارورسانی، ۳) درمان گرمایشی تومورها با فرکانس امواج رادیویی و ۴) به عنوان عوامل افزایش کنتراست تصویربرداریهایی مثل[۳] به کار میرود، اهمیت قابل توجهی دارند.
نحوۀ کاربری این فناوری، مبتنی بر تاثیر میدانهای مغناطیسی خارجی بر روی نانوذرات مغناطیسی آهن پوشش داده شده با پلیمر است که به عنوان حاملهای دارویی به کار میروند. این نوع کاربری فیزیکی، قادر است ذرات را به سمت اهداف درمانی مورد نظر انتقال داده و در آنجا جمعآوری کند. علاوهبر آن، خاصیت نانومتری این ذرات، امکان برهمکنش با هستۀ سلولها و به همین ترتیب مادۀ ژنتیکی آنها را فراهم میکند. طراحی موثر نانوذرات مغناطیسی به عنوان حامل مواد دارویی یک کار بسیار پیچیده است و اصول مهمی مثل توانایی حمل و نگهداری باردارویی مناسب، توانایی حمل چندین دارو و مواد شیمیایی برای بهبود اثر بخشی درمانی و مکانیسم و میزان آزاد سازی دارو باید در نظر گرفته شود[۸].
اهمیت قابل توجه سیستم دارورسانی هدفمند، در مطالعات علوم مغز، اعصاب و رفتارشناسی، شناخته شده است. تحریک و مهار فعالیت الکتریکی غشای سلولهای عصبی مغز با استفاده از میکروالکترود، از متداولترین روشهای علمی بررسی عملکرد و ارتباطات شبکههای عصبی است. تیمار دارویی مغز با تزریق مستقیم دارو، به یک روش تهاجمی بیهوش کردن حیوان مدل، باز کردن جمجمه و کاشت لوله در مغز نیاز دارد. دانشمندان دانشگاهMIT در جدیدترین پژوهشهای خود یک سیستم تحویل دارو، با بیشترین دقت و کمترین تهاجم را توسعه دادند که با یک میدان مغناطیسی خارجی کنترل میشود. همانطور که در شکل ۴ مشاهده میکنید؛ در این سامانه، نانوذرات مغناطیسی به همراه دارو در کرههای لیپیدی بستهبندی میشوند. هنگامیکه سامانۀ حامل در یک میدان مغناطیسی متناوب با فرکانس بالا قرار میگیرد، نانوذرات به میزان 5درجه سانتیگراد گرم شده و کرههای چربی متخلخل میشوند تا بدون آزاد کردن نانوذرات مغناطیسی، مواد دارویی در ناحیۀ مورد نظر مغزی رها کنند. با خاموش شدن میدان مغناطیسی، کرههای لیپیدی مهروموم شده و آزادسازی دارو متوقف میشود. این سیستم تحویل کنترلشده با میدان مغناطیسی، به طور گسترده برای انواع داروها کاربرد دارد[۹].

شکل ۴- تصویر آزمایشگاه و شماتیک یک موش آزمایشگاهی که در سیمپیچ میدان مغناطیسی متناوب قرار گرفته است[۹].
۲-۴- امواج فراصوت
استفاده از امواج فراصوت از دهه ۱۹۵۰ به طور گستردهای برای بهبود تحویل دارو به بافتهای مورد هدف در بدن شناخته شده است[۸]. فرکانس و شدت مشخص امواج فراصوت، روی سلولها و بافتهای زندهای که در معرض انرژی موجهای فراصوت قرار گرفتهاند، تاثیرات بیوفیزیکی مختلفی مثل سونوپوراسیون[۴]، حفرهزایی و هایپرترمی میگذارد. هرکدام از این تغییرات، اثرات مختلفی روی عملکردهای سلول داشته وبرای مقاصد درمانی متفاوتی به کار میآیند[۹].
در فرآیند سونوپوراسیون، تحت اثر نیروی مکانیکی امواج فراصوت، اندازۀ منافذ غشای پلاسمایی افزایش مییابد. امواج فراصوت، ضمن از بین بردن یکپارچگی غشای پلاسمایی و ایجاد تخلخل، ورود غیرفعال نانوذرات و حاملهای دارویی را امکانپذیر میکنند.
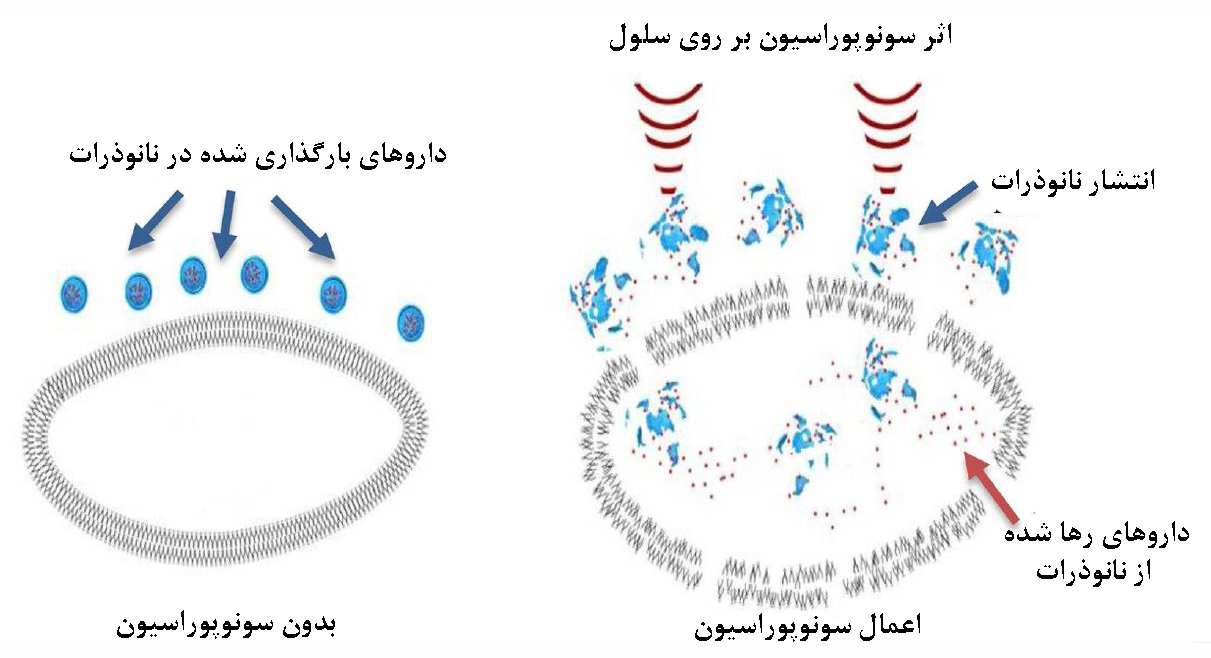
شکل ۵- تاثیر امواج فراصوت بر روی سلول در فرآیند سونوپوراسیون[۹].
یکی دیگر از روشهای دارورسانی به واسطه امواج فراصوت، میکروحبابهای حاوی ترکیبات دارویی هستند که تسهیل جذب سلولی آنها با استفاده از یک میدان فراصوت خارجی انجام میشود[۹]. میکروحبابها، ساختاری دولایه دارند و شامل یک هستۀ گازی شکل (عمدتا پرفلوئوروکربن یا )[۳] و یک غشای پلیمری (مثل میسلهای پلیمری) یا لیپیدی (مثل لیپوزوم) هستند که معمولا از راه تزریق درون وریدی وارد بدن میشوند[۸]. پس از اعمال امواج فراصوت، حبابهای ریزی درون غشای این ذرات تولید میشود. به این پدیده حفرهزایی[۵] گفته میشود. به تدریج که به تعداد حبابهای ریز افزوده میشود منافذ غشا افزایش مییابد. در ادامه، تا جایی که سامانۀ حامل، تحمل افزایش بیشتر فشار داخلی را داشته باشد، به تدریج دارو در محل مطلوب خود از حامل جدا میشود[۳]. در شکل (۶) طرحی از ارسال امواج فراصوت به میکروحبابها و آزادشدن دارو در بافت سرطانی نمایش داده شده است.
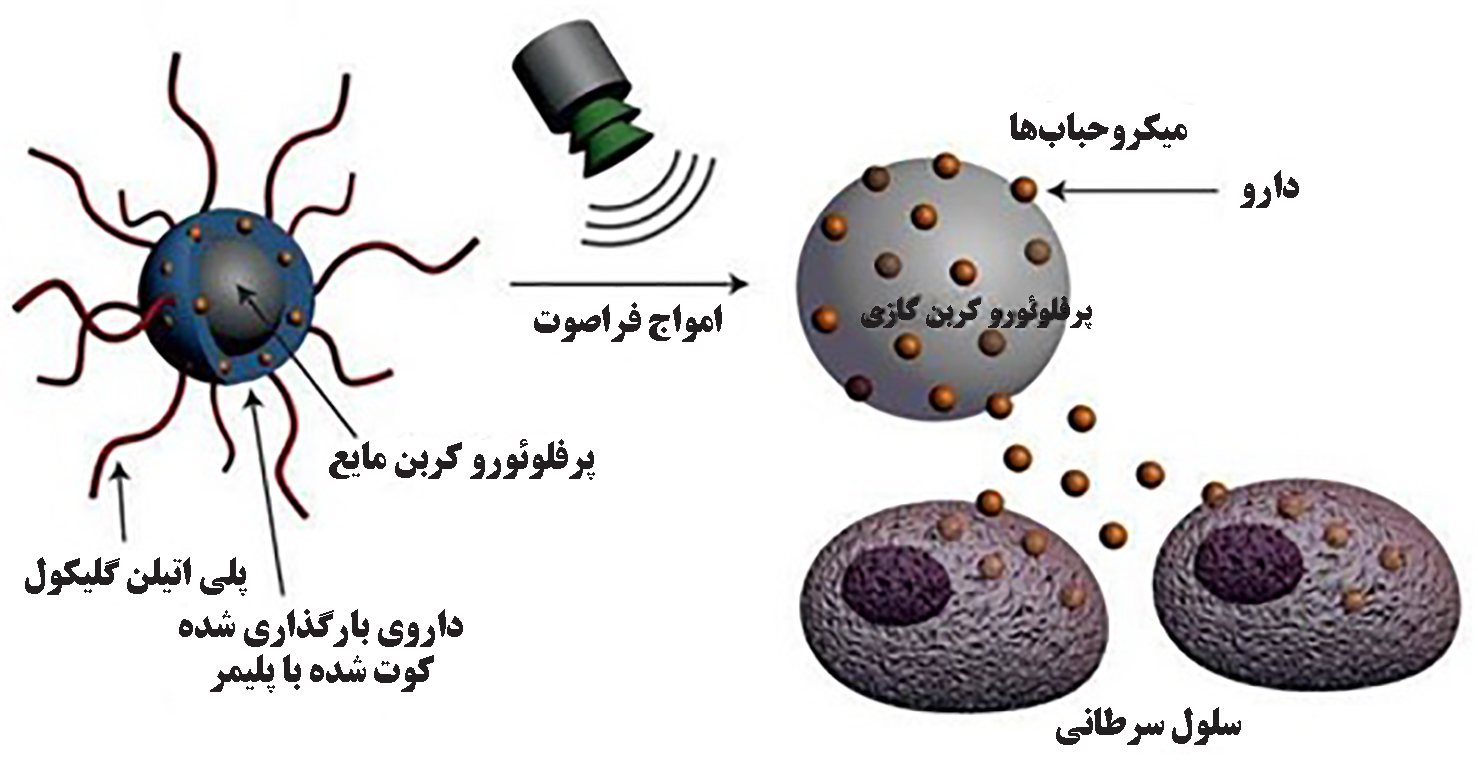
شکل ۶- ارسال امواج فراصوتی به میکروحباب و آزاد شدن دارو در بافت سرطانی[۳]
|
کادر آموزشی: کارآزماییهای بالینی مهمترین مطالعات پزشکی بر روی انسانها برای بررسی اثرات دارو و شیوههای درمانی جدید است. در مرحله I بهترین راه به کارگیری روش درمانی و دوز موثر فرمول دارویی جدید مشخص میشود. مرحله II مطالعهای برای آزمودن اثرات ضدسرطانی دارو است. در مرحله III نتایج درمان افراد با کاربرد درمانی جدید با روشهای متعارف درمانی مقایسه میشود مرحله IV مطالعه درمورد عوارض جانبی داروهایی است که با تائید کاربری به بازار عرضه شده است. |
۳-۴- دما
سونوپوراسیون و حفرهزایی به عنوان اثر غیرحرارتی امواج فراصوت شناخته میشوند. مدل سوم از تاثیرات امواج فراصوت، هایپرترمی است. امواج فراصوت در بافت زنده باعث چرخش یا لرزش مولکولهای زیستی میشود. این حرکات مکانیکی و فشار متراکم سازی، منجر به گرما و هایپرترمی موضعی در بافتهای مورد نظر میشود[۸]. فقط چند سامانۀ لیپوزومی حساس به دما وارد مرحلۀII یا III کارآزماییهای بالینی شدهاند. برای مثال، ThermoDox، داروی دوکسوروبیسین برای درمان سرطان سینه و کبد، در مرحلۀ III و Allovectin یک روش ژندرمانی برای ملانوما در مرحله II هستند. بیشتر این سامانهها از لیپیدهایی با دمای انتقال فاز در حدود ۴۰ درجه سانتیگراد ساخته شدهاند، که این دما با فرکانس امواج رادیویی یا امواج فراصوت با شدت زیاد حاصل میشود[۴]. در شکل (۷) طرحی از تاثیر گرمایشی و فیزیکی امواج فراصوت روی سامانه های حمل دارو را نمایش میدهد.
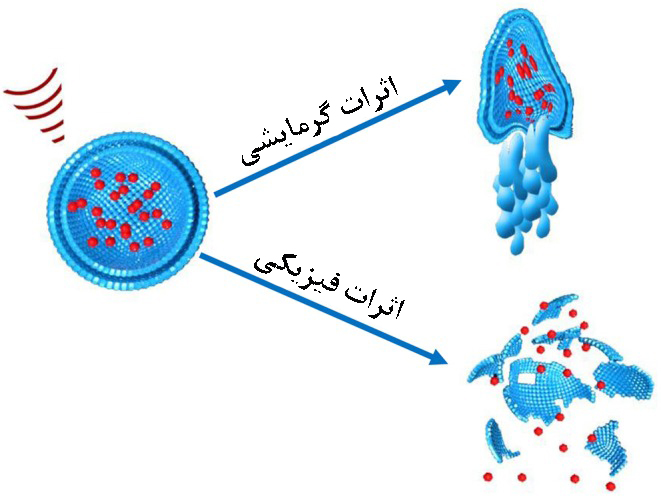
شکل ۷- تاثیر گرمایشی و فیزیکی امواج فراصوت روی سامانههای حمل دارو[۹].
۴-۴- نور
ویژگیهای درمانی و کاربرد پزشکی نور از دیرباز شناخته شده است. با این حال در قرن اخیر روشهای درمان مبتنی بر نور ()[۶] به خوبی توسعه یافتهاند[۸]. تمام خصوصیات فیزیکی طیفهای نور از قبیل شدت و طولموج، با استفاده از فیلتر، فتوماسک و یا لیزر قابل تنظیم است. در طی چند سال گذشته سازوکارهای زیادی برای رهایش یکباره و یا چندباره دارو برای سامانههای حساس به نور متصل به نانوذرات، طراحی شدهاست. اما مهمترین مشکل این روش، محدود بودن عمق نفوذ نور به بدن است که در برخی موارد، این محدودیت با استفاده از موادی که به طولموجهای بالاتری حساس هستند و یا با بهرهبرداری از تکنولوژیهای دو فوتونی و استفاده از لیزر مادون قرمز نزدیک قابل رفع است[۳]. طولموج مشخص از طیف فرابنفش، مرئی یا مادون قرمز نزدیک در حوزۀ دارورسانی هدفمند به عنوان یک روش غیرتهاجمی، با امکان کنترل از راه دور در دو بعد فضا و زمان کاربرد دارد. ناحیه مادون قرمز ()[۷] با توجه به عمق نفوذ بالاتر، پراش اشعه و احتمال آسیب بافتی کمتری دارد و از این رو برای کاربردهای داخل بدن و آزمایشهای بالینی بسیار مناسبتر است[۸].
براساس مطالعات، هنگامی که داروی ضد سرطان دوکسوروبیسین که در نانوکرههای توخالی طلا بارگیری شدهاند در معرض تابش ۸۰۸ نانومتر قرار بگیرند، فعالیت ضدسرطانی بیشتر و سمیت سیستماتیک کمتری نسبت به داروی آزاد خواهد داشت. همانطور که در شکل۹ مشاهده میشود، تبدیل تابش به حرارت به وسیله موج مادون قرمز نزدیک، موجب افزایش سرعت رهایش ترکیبهای دارویی گیرانداخته شده و دهیبریدازیسون رشتههای نوکلئیک اسید متصل به نانومیلههای طلا میشود[۳].

شکل ۸- تابش اشعه مادون قرمز نزدیک و رهاشدن داروی دکسوروبیسین محبوس شده درون رشتههای [۳]
۵-۴- میدان الکتریکی
الکتروپوراسیون از دهه ۱۹۸۰ معرفی شده است و نشان میدهد که تکانههای الکتریکی با ولتاژ بالا، باعث افزایش نفوذپذیری سلول میشود. این اصطلاح به این واقعیت اشاره دارد که تشکیل نانوحفرات در غشای پلاسمایی، امکان انتقال حاملهای دارو و ژندرمانی و مولکولهایی شامل پروتئینها، آنتیبادیها و الیگونوکلئوتیدها در شرایط آزمایشگاهی، داخل بدن و آزمایشهای بالینی را فراهم میکند[۸].
۵- جمعبندی و نتیجهگیری
مهندسی زیستپزشکی با کمک سیستمهای تحویل دارویی که از نظر فیزیکی کنترل میشوند، دوز مصرفی و محل تجمع دارو برای برنامههای بالینی امیدوارکننده از جمله درمان سرطان و دارورسانی به مغز، بهبودبخشی موثری دارد. الکتروپوراسیون و امواج فراصوت با افزایش نفوذپذیری بافتها جهت عبور مواد دارویی، یک فناوری تسهیلکننده است. اعمال میدان خارجی مغناطیسی برای تجمع کنترل شدۀ داروها در اقدامات درمانی، نتایج خوبی به دست آورده است و نتایج نشان دادهاند که استفاده از سامانههای حامل که نسبت به محرکهای مختلف پاسخ میدهند، امکان رسانش هدفمند دارو، به نواحی مشخص مغز و تومورهای سراسر بدن را فراهم میکنند.
۶- مراجع
[۱] پاپازوگلو، اليزابت; پارتاساراسي، آراويند; زیست فناوری نانو .دکتر حميد راشدي، دکتر قاسم عمو عابديني، مهندس سميه اسکندري. تهران: دانشگاه تهران، ۱۳۸۹
[۲] فائزه کیانی، محمد احمدی، محسن نوری. "کاربرد فناوری نانو در دارورسانی" اولین همایش ملی نانوتکنولوژی مزایا و کاربردها، همدان، دانشکده شهید مفتح،۱۳۹۲
[۳] سید محمدجواد حسینی زاده. "مروری بر مهمترین مکانیسمها و سیستمهای دارورسانی هدفمند". فصلنامه بیولوژی کاربردی, ۶, ۲۱, ۱۳۹۵, ۱۷-۲۸.
[4] Felice, Betiana, et al. "Drug delivery vehicles on a nano-engineering perspective." Materials Science and Engineering: C 41 (2014): 178-195.
[5] Kamaly, Nazila, et al. "Degradable controlled-release polymers and polymeric nanoparticles: mechanisms of controlling drug release." Chemical reviews 116.4 (2016): 2602-2663Borowy, Christopher [6] S., and John V. Ashurst. "Physiology, Zero and First Order Kinetics." (2019).
[۶] آرزو قادی، رابعه مهرآور، مروری کوتاه بر کاربرد نانوذرات در دارورسانی هدفمند، همایش ملی کاربرد نانوتکنولوژی در علوم محض و کاربردی، دانشکده مهندسی شیمی، دانشگاه آزاد اسلامی، آمل، ۱۳۸۸
[7] Rodriguez-Devora, Jorge I., et al. "Physically facilitating drug-delivery systems." Therapeutic delivery 3.1 (2012): 125-139.
[8] Rao, Siyuan, et al. "Remotely controlled chemomagnetic modulation of targeted neural circuits." Nature nanotechnology 14.10 (2019): 967-973.
[9] Tharkar, Priyanka, et al. "Nano-Enhanced Drug Delivery and Therapeutic Ultrasound for Cancer Treatment and Beyond." Frontiers in Bioengineering and Biotechnology 7 (2019).
۷- پاورقی
[1]electroporation
[2]biomedical engineering
[3]Magnetic resonance imaging (MRI)
[4]Sonoporation
[5]cavitation
[6]photodynamic therapy
[7]near-infrared