دوشنبه 15 فروردین 1401 کد خبر: 123
۱- هدف
هدف از انجام این آزمایش، اندازهگیری سختی آب میباشد. همچنین از این روش میتوان برای سنجش کیفیت آب تصفیه شده در آزمایش شماره ۷ با عنوان "ساخت ستون تصفیه آب" استفاده نمود.
۲- تئوری آزمایش
آب مایه حیات است. شاید این جمله را بارها شنیدهاید؛ اما تا زمانی که بحران آب در جهان بطور جدی مطرح نشد، هیچکس موضوع آب را جدی نگرفت. آب تنها نوشیدنی در جهان است که هیچگونه جایگزینی ندارد و بدن ما برای ایفای نقش درست بطور روزانه به آب سالم نیاز دارد.
اگر آب حاوی نمکهای معدنی مانند کلسیم، روی، آهن، منیزیم و یا ترکیبات بیکربنات باشد به آن آب سخت میگویند. معمولا سختی آب به دو قسمت سختی موقت و سختی دائم تقسیم میشود. منظور از سختی موقت یا سختی بی کربناتی، املاح بی کربنات کلسیم و منیزیم است که در اثر حرارت دادن از حالت محلول به صورت غیر محلول در میآید. منظور از سختی دائم یا سختی غیر کربناتی، املاح سولفات و کلرید و نیترات و ...کلسیم و منیزیم است که در اثر حرارت دادن رسوب نمیکنند. نمکهای کلسیم و منیزیم موجب سختی آب شده و در هنگام شستشو، تولید صابونهای نامحلول میکند که معمولا از نوع کلسیم و منیزیم میباشند.
در صنعت، استفاده از آب سخت مجاز نمیباشد، زیرا وجود سختی در آب دیگهای بخار باعث ایجاد رسوب در دیگ و مسیرهای آب میگردد. در سیستمهای سرد کننده، رسوب در دستگاههای تبادل حرارتی، اطراف موتورها و لولهها و بطور کلی در تمام نقاطی که آب در آنها جریان داشته و در معرض تغییر درجه حرارت است، تشکیل میگردد. همچنین، صابونهای نامحلول حاصل از شست و شو در آب سخت میتوانند در پارچهها رسوب کرده و زیر دست را خشن کنند و از سوی دیگر به صورت نامتوازن رسوب کرده و در نتیجه باعث عدم یکنواختی در واحدهای رنگرزی میشوند. بعلاوه، یون های کلسیم و منیزیم میتوانند بعضی از رنگها را از محیط عمل خارج کرده و رسوب دهند.
کربناتهای کلسیم و منیزیم در آب نامحلول میباشند ولی زمانی که دی اکسید کربن در کنار آنها قرار میگیرد آنها را به صورت بیکربناتهای محلول در آب در میآورد. حال اگر با جوشاندن، دی اکسید کربن را از آب خارج کنیم بیکربناتهای محلول مجددا به صورت کربنات نامحلول در آمده و رسوب میکنند و از آب خارج میشوند. به این دسته از مواد موجود در آب که با جوشاندن خارج میشوند سختی موقت گویند. جهت حذف سختی موقت نیازی به دستگاه سختیگیر نیست.
سایر نمکهای منیزیم و کلسیم باقیمانده در آب که با جوشاندن از بین نمیروند را سختی دائم گویند. این مواد کلرور ها، سولفاتها و یا نیتراتهای کلسیم و منیزیم میباشند. اصطلاح سختی کل به معنی مجموع سختی ناشی از کلسیم و منیزیم است:
سختی منیزیمی + سختی کلسیمی = سختی کل
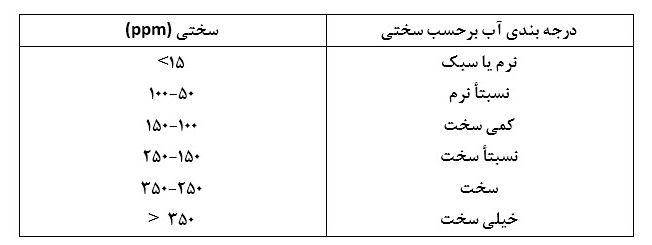
سختی آب را بر حسب مقدار کلسیم کربنات و با واحد ppm یا واحد بر میلیون بیان میکنند. جدول ۱ مقادیر قراردادی سازمانهای بهداشتی برای درجه سختی آب را نشان میدهد.
جدول ۱- درجات سختی آب بر حسب غلظت.
سختی آب را میتوان با نرم کردن به وسیله آهک، سدیم کربنات یا استفاده از تعویض کنندههای یونی و یا مخلوطی از هر دو از بین برد. یونهای کلسیم و منیزیم هر دو به سادگی در حضور نمک دی سدیم اتیلن دی امین تتراستیک اسید (EDTA) کمپلکس میشوند. منیزیم در pH بالاتر از ۱۲ بصورت هیدروکسید Mg(OH)2 ته نشین میشود و یونهای کلسیم در محلول باقی میمانند. بنابراین در۱۳-۱۲= pH فقط یونهای کلسیم موجود در نمونه با EDTA ترکیب میشوند. از این رو، روش تیتراسیون با محلول EDTA برای تعیین میزان سختی آب بسیار رایج است.
۳- روش کار آزمایش
۱-۳- مواد و تجهیزات مورد نیاز
۲-۳- روش انجام آزمایش
۱-۲-۳- تعیین سختی کل
ابتدا ۵۰ میلیلیتر از نمونه آب انتخاب شده را داخل ارلن تیتراسیون بریزید. سپس 2 میلیلیتر بافر آمونیاکی با ۱۰ = pH به ارلن اضافه شود. پس از ۲۰ ثانیه همزدن ارلن، مقدار ۰.۱ گرم شناساگر اریوکروم بلک تی (BT) را به ارلن اضافه کنید. بورت را با ۲۰ میلی لیتر از محلول EDTA با غلظت ۰.۰۱ مولار پر کرده، سپس شیر بورت را به آهستگی باز و تیتراسیون را آغاز کنید. در حین اضافه شدن قطرات EDTA با فاصله زمانی ۵-۳ ثانیه، ارلن را تکان دهید تا بطور یکنواخت مخلوط شود. تیتراسیون را ادامه داده تا زمانی که تغییر رنگ از بنفش (قرمز شرابی) به آبی (نقطه پایان تیتراسیون) اتفاق بیفتد (مطابق شکل ۱). در نقطه پایانی رنگ محلول تغییر کرده و این بدان معناست که دیگر واکنشگر EDTA اضافه نکنید. حجم مصرفی EDTA را یادداشت کرده و در رابطه زیر قرار دهید:
A × B × 105= سختی کل
A = حجم مصرفی EDTA بر حسب میلی لیتر
B = غلظت محلول EDTA
۲-۲-۳- تعیین سختی کلسیمی در حضور منیزیم
ابتدا ۲۰ میلیلیتر آب را در ارلن رقیق کنید تا PH به حدود ۵ برسد. سپس ۱ میلی لیتر از محلول بازدارنده سدیم سولفید و ۶ قطره معرف کالکن اضافه کرده و با محلول استاندارد EDTA تیتراسیون را آغاز کنید و تا ظهور رنگ آبی تیتراسیون را ادامه دهید. حجم مصرفی EDTA را یادداشت کرده و در رابطه زیر قرار دهید.
A × B × 105= سختی کلسیمی
A = حجم مصرفی EDTA بر حسب میلی لیتر
B = غلظت محلول EDTA
سختی ناشی از منیزیم نیز از رابطه زیر بدست می آید:
سختی کلسیمی – سختی کل = سختی منیزیمی
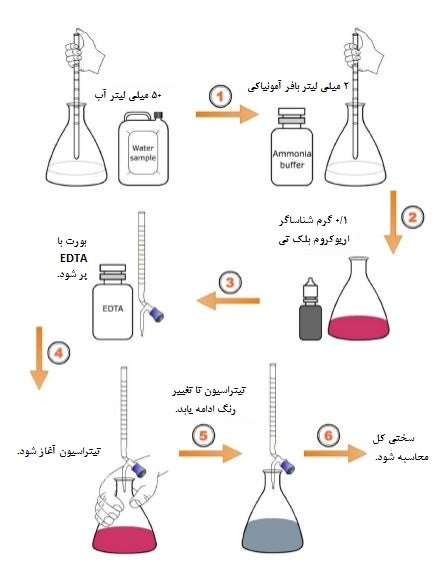
شکل۱- روش تیتراسیون با EDTA.
۵- پرسش